碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32-  2I-+ S4O62-(快)
2I-+ S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 |
体积V/mL |
||||
| K2S2O8溶液 |
水 |
KI溶液 |
Na2S2O3溶液 |
淀粉溶液 |
|
| ① |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
| ② |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
| ③ |
8.0 |
Vx |
4.0 |
4.0 |
2.0 |
表中Vx mL,理由是 。
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s) 2LiI(s)ΔH
2LiI(s)ΔH
已知:①4Li(s)+O2(g) 2Li2O(s) ΔH1
2Li2O(s) ΔH1
②4LiI(s)+O2(g) 2I2(s)+2Li2O(s)ΔH2
2I2(s)+2Li2O(s)ΔH2
则电池反应的ΔH= ;碘电极作为该电池的 极。
是新型降压药替米沙坦的中间体,可由下列路线合成:
(1)
的反应类型是,
的反应类型是,
的反应类型是。
(2)写出满足下列条件的B的所有同分异构体(写结构简式)。
①含有苯环②含有酯基③能与新制
反应
(3)
中含有的官能团名称是。已知固体
在加热条件下可溶于甲醇,下列
的有关说法正确的是。
a.使用过量的甲醇,是为了提高D的产率 b.浓硫酸的吸水性可能会导致溶液变黑
c. 甲醇既是反应物,又是溶剂 d. D的化学式为
(4)E的同分异构体苯丙氨酸经聚合反应形成的高聚物是(写结构简式)。
(5)已知 在一定条件下可水解为
在一定条件下可水解为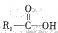 和
和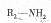 ,则F在强酸和长时间加热条件下发生水解反应的化学方程式是。
,则F在强酸和长时间加热条件下发生水解反应的化学方程式是。
、
、
、
是元素周期表前四周期中的四种常见元素,其相关信息如下表;
| 元素 |
相关信息 |
|
的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
| 常温常压下,
单质是淡黄色固体,常在火山口附近沉积 |
|
| 和 同周期, 的电负性大于 | |
| 的一种核素的质量数为63,中子数为34 |
(1)
位于元素周期表第周期第)族,
和
最高价氧合物对应的水化物的酸性较强的是(化学式)
(2
是一种常用的溶剂,
的分子中存在个
键。在
,
两种共价键中,键的极性较强的是,键长较长的是。
(3)
的基态原子核外电子排布式是。
在空气中煅烧生成的
化学方程式是。
(4)处理含
验到气污染的一种方法,是将其在催化剂作用下转化为单质
。
已知:
此反应的热化学方程式是
、
、
、
、
五种元素的原子序数依次增大。
、
、
、
是组成蛋白质的基础元素,
是地壳中含量最高的金属元素。
回答下列问题:
⑴
的元素符号为 ;
在元素周期表中的位置为;五种元素的原子半径从大到小的顺序是(用元素符号表示)。
⑵
、
两元素按原子数目比l∶3和2∶4构成分子
和
,
的电子式为,
的结构式为。
⑶ 硒(
)是人体必需的微量元素,与
同一主族,
原子比
原子多两个电子层,则
的原子序数为,其最高价氧化物对应的水化物化学式为。该族2 ~ 5周期元素单质分别与
反应生成l
气态氢化物的反应热如下,表示生成1
硒化氢反应热的是(填字母代号)。
a.+99.7
b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
⑷ 用
单质 作阳极,石墨作阴极,
溶液作电解液进行电解,生成难溶物
,
受热分解生成化合物
。写出阳极生成
的电极反应式;由
生成
的化学方程式:。
作阳极,石墨作阴极,
溶液作电解液进行电解,生成难溶物
,
受热分解生成化合物
。写出阳极生成
的电极反应式;由
生成
的化学方程式:。
有机化合物
的转换关系如下所示:
请回答下列问题:
(1)链烃
有支链且只有一个官能团,其相对分子质量在65~75之间,1
完全燃烧消耗7
氧气,则
的结构简式是,名称是_;
(2)在特定催化剂作用下,
与等物质的量的
反应生成
。由
转化为
的化学方程式是;
(3)
与金属钠反应能放出气体,由
转化为
的化学方程式是;
(4)①的反应类型是;③的反应类型是
(5)链烃
是
的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊烷,写出
所有可能的结构简式
(6)
也是
的一种同分异构体,它的一氯代物只有一种(不考虑立体异构,则
的结构简式为。
在溶液中,反映
分别在三种不同实验条件下进行,它们的起始浓度均为
、
及
。反映物
的浓度随时间的变化如下图所示。

请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②;
③;
(2)实验②平衡时
的转化率为;实验③平衡时
的浓度为;
(3)该反应的
>0,判断其理由是;
(4)该反应进行到4.0
时的平均反应速度率:
实验②:
=;
实验③:
=。