铅蓄电池是一种用途极广的二次电池,其电池反应为:
下列说法不正确的是
| A.放电时,负极质量增加 |
| B.充电时,应将外接直流电源的正极与蓄电池的铅电极相接 |
C.放电时,正极反应为: |
| D.铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4 |
已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)=CO2(g)△H=-393.51 kJ·mol-1
C(金刚石)+O2(g)=CO2(g)△H=-395.41 kJ·mol-1
据此判断,下列说法中正确的是。
| A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 |
| B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高 |
| C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 |
| D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高 |
下式表示一种有机物的结构,关于它的性质叙述中不正确的是 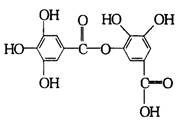
| A.它有酸性,能与纯碱溶液反应 | |
| B.它可以水解,水解产物只有一种 | |
| C.1 mol该有机物最多能和7 mol NaOH反应 | D.该有机物能发生取代反应 |
接触法制硫酸和工业制硝酸分别经过以下变化: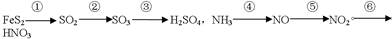
下列说法正确的是:
| A.所有变化都是氧化还原反应 | B.②③⑤⑥都是化合反应 |
| C.②④反应都不需要催化剂 | D.②④反应需要足量的氧气 |
在酸性溶液中能大量共存且为无色透明溶液的是
| A.NH+ Al3+ SO42- NO3- | B.K+ Na+NO3-SO32- |
| C.K+Fe2+ SO42-NO3- | D.Na+ HCO3- K+ NO3- |
H++OH-=H2O表示下列哪组离子反应
| A.Cu(OH)2与H2SO4 | B.Ba(OH)2与H2SO4 |
| C.Fe(OH)3与HCl | D.KHSO4与KOH |