下列各组离子在对应溶液中可能大量存在的是
| A.水电离出的c(H+)=10-12mol·L-1的溶液:K+、Cu2+、SO32-、MnO4- |
| B.与铝粉反应能放出氢气的溶液:Na+、SO42-、HCO3-、Cl- |
| C.含有大量ClO-的溶液:H+、I-、SO42-、Cl- |
| D.pH=12的溶液:K+、Cl-、SO32-、SiO32- |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是()
A.反应的化学方程式为2M N N |
| B.t2时,正、逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
关于化学电源的叙述,错误的是()
| A.化学电源均是根据原电池的工作原理设计的 |
| B.在干电池中,碳棒只起导电作用,并不参加化学反应 |
| C.镍镉电池不能随意丢弃的主要原因是镍、镉的资源有限,价格昂贵 |
| D.燃料电池是一种高效、环保的新型化学电源 |
已知反应A+3B====2C+D在某段时间内以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为()
| A.0.5 mol·L-1·min-1 | B.1 mol·L-1·min-1 | C.2 mol·L-1·min-1 | D.3 mol·L-1·min-1 |
已知空气—锌电池的电极反应为:
锌片:Zn+2OH--2e-====ZnO+H2O
石墨: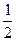 O2+H2O+2e-====2OH-
O2+H2O+2e-====2OH-
据此判断锌片是()
| A.负极,被氧化 |
| B.负极,被还原 |
| C.正极,被氧化 |
| D.正极,被还原 |
在0.1 mol·L-1 CH3COOH溶液中存在电离平衡CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)不变 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |