(12 分)【选做题】本题包括A、B 两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按 A 小题评分。
A. [物质结构与性质]
由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、 H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe原子的价层电子排布式
(2)溶液中CH3COOH分子和NH3分子之间能不能形成稳定的氢键?
(3)CO2分子中碳原子的杂化轨道类型是 ;1 mol CH3COOH中含有的σ键的数目为
(4)TiO2的天然晶体中,最稳定的一种晶体结构如下图,黑球表示 原子。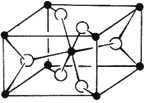
(5)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基离子结合形成的小分子化合物,该化合物中Fe2+与环戊二烯基离子之间以 (填“离子键”、“金属键”、“配位键”、“氢键”、“范德华力”)相结合。
离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________(填编号)。
①单质②氧化物③电解质④盐⑤化合物
(2)一种无色透明溶液中,可能含有下列离子: 、
、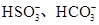 、I-和Cl-,取该溶液进行如下实验:
、I-和Cl-,取该溶液进行如下实验:
①将溶液滴在蓝色石蕊试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色。
③取少许溶液滴入BaCl2溶液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀硝酸的白色沉淀。
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解。
根据以上现象判断,原溶液中肯定不存在的离子是_______;肯定存在的离子是_______;不能作出判断的离子是_______。
已知A、Y为常见金属单质,且Y是短周期元素,Z既可溶于盐酸,又可溶于氢氧化钠溶液。
据图回答问题: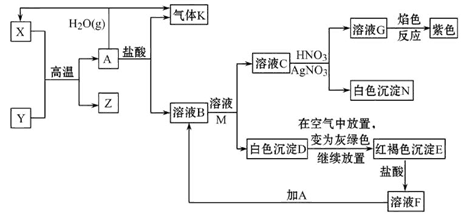
(1)Y在元素周期表中的位置_______________________。
(2)Z与氢氧化钠溶液反应的离子方程式为____________________________。
(3)B与M反应的化学方程式为______________________________________。
(4)A与水蒸气反应的化学方程式为__________________________________。
(5)检验溶液F中阳离子的方法是____________________________________。
(6)在沸水中加入F的饱和溶液的离子方程式为_______________________。
阅读以下内容,回答问题。
冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或H2,或CO)法;③活泼金属置换法;④电解法。四种方法各有优缺点,在工业上均有应用。
(1)一种无色气体A与红热的炭反应,得到另一种无色气体B,B与灼热的氧化铜反应,又得到A,则A、B分别为_______(填序号)。
A.O2、CO2 B.O2、CO C.CO2、CO D.CO、CO2
(2)下列说法错误的是_______(填序号)。
A.对废旧金属的最好处理方法是回收再利用
B.提炼金属要经过矿石的富集、冶炼、精炼三步
C.活泼金属的冶炼都是通过电解其盐溶液制得
D.热还原法中还原剂有焦炭、一氧化碳、氢气或活泼金属等
(3)钛(Ti)有“未来钢铁”之称。工业上常以:TiCl4+2Mg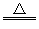 Ti+2MgCl2获得海绵状钛。该反应在下列哪种环境中进行_______ (填序号)。
Ti+2MgCl2获得海绵状钛。该反应在下列哪种环境中进行_______ (填序号)。
A.稀有气体中 B.空气中 C.氮气中 D.CO2气体中
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2∶1的离子化合物丙。
(1)D的原子结构示意图为 ________,丙的电子式为___________,E在周期表中的位置为。
(2)下列说法正确的有。
①化合物乙分子中只含有极性共价键
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应 __________________。
(4)写出一个由以上元素构成的10电子微粒与18电子微粒反应的离子方程式 ____________________________。
(5)甲溶液显(填“酸性”、“碱性”或“中性”),原因是(用离子方程式表示)。
A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA3型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。据此回答下列问题:
(1)D元素在元素周期表中的位置是。
(2)B与D所形成的化合物电子式为。
(3)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,产生淡黄色沉淀,其反应的化学方程式为。
(4)实验室里除去BA2气体,可用下列试剂中的(填字母)。
A.酸性高锰酸钾溶液B.浓硫酸
C.NaOH溶液D.品红溶液
(5)由A、B、D三种元素所组成的某种盐水溶液显碱性,其原因是(用离子方程式表示)。