为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。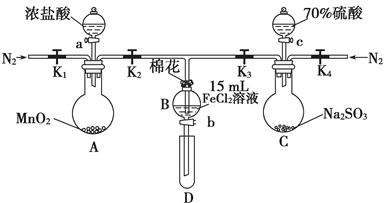
实验过程:
Ⅰ.打开弹簧夹K1~K4 ,通入一段时间N2 ,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a ,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2 。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_____________________________________________________。
(2)检验B中溶液是否还有Fe2+ 的方法之一是:取少量B中溶液于试管中,滴加几滴含有+3价铁元素的配合物溶液,会产生蓝色沉淀,写出该反应的离子方程式 。
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式 。
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为_________________________________________________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是________(填“甲”、“乙”或“丙”)。
| |
过程Ⅳ,B溶液中含有的离子 |
过程Ⅵ,B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO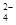 |
| 乙 |
既有Fe3+又有Fe2+ |
有SO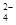 |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(6)将B中的FeCl2溶液换成100mLFeBr2溶液并向其中通入1.12LCl2(标准状况下),若溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
过碳酸钠(2Na2CO3·3H2O2)是一种新型高效固体漂白杀菌剂,它具有无臭、无毒、无污染的特点,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中。依托纯碱厂制备过碳酸钠可降低生产成本,其生产流程如下: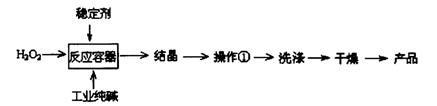
试回答下列问题:
(1)过碳酸钠溶于水后所得溶液一定显(“酸性”、“碱性”或“中性”)。
(2)操作①需要的玻璃仪器有(填写仪器名称)。
(3)工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。
①要检验工业纯碱中杂质的存在,最好选用下列试剂中的(选填序号)。
a.氢氧化钡溶液 b.稀硝酸 c.硫氰化钾溶液 d.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈 漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若,说明装置不漏气。
漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若,说明装置不漏气。
③装置A的作用是,装置C中的试剂为。
④某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要?
(选填“必要”或“不必要”),判断的理 由是。
由是。
已知:在25时H2O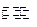 H++OH- KW=10-14
H++OH- KW=10-14
HAC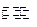 H++A
H++A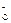 Ka=1.8×10-5
Ka=1.8×10-5
(1)醋酸钠水解的平衡常数Kh的表达式为。当升高温度时,Kh将(填“增大”“减小”“不变”);
(2)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为,a与b的关系为(填“大于”“小于”“等于”);
(3)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为 0.01mol·L-1。向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中能生成沉淀,原因是。(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14、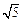 =2.2)
=2.2)
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) CH3OH(g)
CH3OH(g)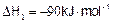
②CO(g)+H2O(g)=CO2(g)+H2(g)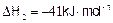
写出由二氧化碳、氢气制备甲醇的热化学方程式;
(2)在压强0.1MPa条件下,容积为 VL的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①P1P2(填大于、小于或等于);
②在其它条件不变的情况下,再增加 amolCO与2amolH2,达到新平衡时,CO的转化率(填“增大”、“减小”或“不变”,下 同),平衡常数。
(3)以甲醇为燃料的新型燃料电池,正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:CH3OH+H2O-6e-=CO2+6H+
①正极的电极反应式是;放电时,H+移向电池的(填“正”或“负”)极。
②若以该燃料电池作为电源,用石墨作电极电解500mL饱和食盐水,当两极共收集到标准状况下的气体1.12L(不考虑气体的溶解)时,所得溶液的pH=(假设反应前后溶液体积不变)。
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
 请回答下列问题:
请回答下列问题: (1)A与银氨溶液反应有银镜生成,则A的结构简式是。
(1)A与银氨溶液反应有银镜生成,则A的结构简式是。 (2)B→C的反应类型是。
(2)B→C的反应类型是。 (3)E的结构简式是。
(3)E的结构简式是。 (4)写出F和过量NaOH溶液共热时反应的化学方程式:
(4)写出F和过量NaOH溶液共热时反应的化学方程式: 。
。 (5)下列关于G的说法正确的是
(5)下列关于G的说法正确的是 a.能与溴单质反应 b.能与金属钠反应
a.能与溴单质反应 b.能与金属钠反应 c.1molG最多能和3mol氢气反应 d.分子式是C9H7O3
c.1molG最多能和3mol氢气反应 d.分子式是C9H7O3
(6)与D互为同分异构体且含酚羟基、属于酯类的有几种: 种
种
A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电 子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式。
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为___________________________________;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)_______________。
(4)C2A4 ─ 空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:正极的电极反应式是__________ _________________________。
_________________________。
(5)已知:2CD2(g)  C2D4(g);△H<0。在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
C2D4(g);△H<0。在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。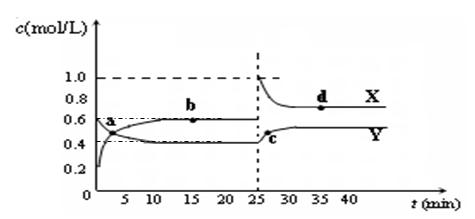
① a、b、c、d四个点中,化学反应处于平衡状态的是_ ______点。
______点。
② 25 min时,增加了_______(填物质的化学式)________mol。
③ a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是_______(填字母)。