(8分)(2011·重庆万州调研)为确认C6H5OH、H2CO3和CH3COOH的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。
请据此实验回答:
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗中所盛试剂应为________。
(2)装置B所盛的试剂是________,其作用是______________________________。
(3)装置C所盛的试剂是________,C中反应的离子方程式是______________________。
实验室需用浓度为18.4 mol•L-1 浓硫酸配制3.68 mol•L-1 的稀硫酸250mL。填写下列空格。
(1)实验步骤(请补全实验操作过程):
①用量筒取浓硫酸__________mL。
②将浓硫酸慢慢注入盛有少量蒸馏水的小烧杯中,并不断搅拌。
③立刻将稀释后硫酸溶液沿玻璃棒注入容量瓶中。
④用少许蒸馏水洗涤小烧杯,将洗涤液沿玻璃棒注入容量瓶并重复_______次。
⑤继续向容量瓶内小心加蒸馏水,直至距离刻度线__________处。
⑥改用胶头滴管加蒸馏水,使液体的凹液面与刻度线相切。
⑦将容量瓶盖紧摇匀,并将所配溶液装入试剂瓶贴好标签。
上述操作有无不当之处,请指出,并加以改正:__________。
(2)实验中除用量筒、烧杯、胶头滴管、玻璃棒外,还用到的玻璃仪器有_______;
(3)若出现如下情况,对所配溶液浓度的影响是(选填“偏高”、“偏低”或“无影响”);
a.没有进行操作步骤④_______;b.开始时容量瓶没有干燥__________;
(4)其实验过程中出现如下情况应如何处理?
a.定容时加蒸馏水不慎超过了刻度线____________;
b.向容量瓶中转移溶液时(步骤②)不慎有液滴掉在容量瓶外面___________。
已知:甲、乙、丙为常见单质,甲常温下为固体,乙为一黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为一红褐色沉淀,它们之间有下图转化关系。请回答以下问题。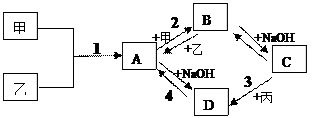
(1)写出下列物质的化学式;乙;B。
(2)写出3反应的化学方程式。
(3)写出2反应的离子方程式:。
某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在下方的括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案。
并写出有关离子方程式
在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,是氧化剂(填化学式,下同);是还原剂; 元素被氧化;元素被还原;是氧化产物;是还原产物;电子转移的总数是;用双线桥法表示电子转移的方向和数目:
现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为_ ____mol。
(2)该气体所含原子总数为___ _个。
(3)该气体在标准状况下的体积为 _____L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为__ _。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为__ _mol/L。