在1200℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+ 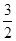 O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)= 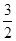 S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
H2S(g)+ 1/2O2(g)=S(g)+H2O(g) △H3
2S(g) =S2(g) △H4
则△H4的正确表达式为
A.△H4=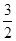 (△H1+△H2-3△H3) (△H1+△H2-3△H3) |
B.△H4=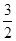 (3△H3-△H1-△H2) (3△H3-△H1-△H2) |
C.△H4=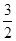 (△H1+△H2+3△H3) (△H1+△H2+3△H3) |
D.△H4= 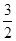 (△H1-△H2-3△H3) (△H1-△H2-3△H3) |
相同条件下,气体A与氧气的质量比为2:1,体积比为4:1,气体A的相对分子质量是()
| A.16 | B.17 | C.44 | D.64 |
某氯化镁溶液的密度为1.18g•cm-3,其中镁离子的质量分数为5.11%。300mL该溶液中Cl-离子的物质的量约等于()
| A.0.37mol | B.0.63mol | C.0.74mol | D.1.5mol |
在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是()
| A.Mg | B.Cu | C.Ag | D.H2 |
根据下列反应判断有关物质还原性由强到弱的顺序是()
H2SO3+I2+H2O H2SO4+2HI 2FeCl3+2HI
H2SO4+2HI 2FeCl3+2HI 2FeCl2+2HCl+I2
2FeCl2+2HCl+I2
3FeCl2+4HNO3 2FeCl3+NO↑+2H2O+Fe(NO3)3
2FeCl3+NO↑+2H2O+Fe(NO3)3
| A.H2SO3>I->Fe2+>NO | B.I->Fe2+>H2SO3>NO |
| C.Fe2+>I->H2SO3>NO | D.NO>Fe2+>H2SO3>I- |
下列事实能说明氯化氢是共价化合物的是( )
| A.其水溶液能导电 | B.极易溶于水 |
| C.是一种具有刺激性气味的气体 | D.熔化状态下不导电 |