(1)质量之比为16∶7∶6的三种气体SO2、CO、NO,分子数之比为________;氧原子数之比为________;相同条件下的体积之比为________。
(2)标准状况下,1.7 g NH3的体积为______L,它与标准状况下________ L H2S含有相同数目的氢原子。
(3)某气体氧化物的化学式为RO2,标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为________,R的相对原子质量为________。
《茉莉花》是一首脍炙人口的江苏民歌.茉莉花香气的成分有多种, 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和
乙醇为原料进行人工合成.一种合成路线如下: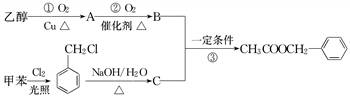
(1)写出反应①的化学方程式:__________________________________________.
(2)反应③的反应类型为______________________________________________.
(3)反应________(填序号)原子的理论利用率为100%,符合绿色化学的要求.
(4)C的结构简式为__________________________________________________,
C通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种)________________________________.
由E(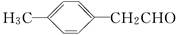 )转化为对甲基苯乙炔
)转化为对甲基苯乙炔
( )的一条合成路线如下:
)的一条合成路线如下: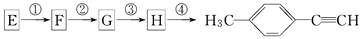 (G为相对分子质量为118的烃)
(G为相对分子质量为118的烃)
(1)写出G的结构简式:____________________.
(2)写出①~④步反应所加试剂,反应条件和①~③步反应类型:
| 序号 |
所加试剂及反应条件 |
反应类型 |
| ① |
||
| ② |
||
| ③ |
||
| ④ |
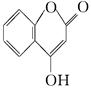 是一种医药中间体,常用来制备抗凝血药,
是一种医药中间体,常用来制备抗凝血药,
可通过下列路线合成: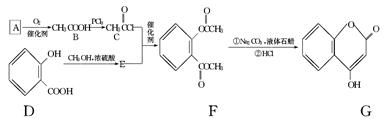
(1)A与银氨溶液反应有银镜生成,则A的结构简式是____________________.
(2)B→C的反应类型是________________________.
(3)E的结构简式是________________________.
(4)写出F和过量NaOH溶液共热时反应的化学方程式:________________________________________________________________________.
(5)下列关于G的说法正确的是________.
a.能与溴单质反应
b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应
d.分子式是C9H6O3
有机化合物A~H的转换关系如下图所示: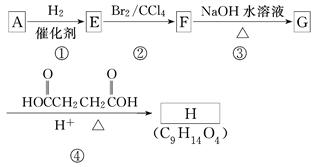
请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol 氧气,则A的结构简式是________,名称是________.
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E,由E转化为F的化学方程式是________________________________________________________________________
________________________________________________________________________.
(3)G与金属钠反应能放出气体,由G转化为H的化学方程式是________________________________________________________________________.
(4)①的反应类型是________;③的反应类型是________.
(5)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊烷,写出B所有可能的结构简式______________________.
(6)C也是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构),则C的结构简式为________.
已知:①有机物X的相对分子质量小于180,其中氧的质量分数约为49.4%,②1 mol X在稀硫酸中发生水解反应生成2 mol 甲醇和1 mol A,③X中没有支链.④有机物X、A物质能发生如下图转化关系,E为高分子的化合物,B为环状结构.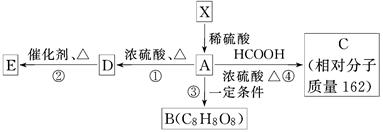
根据以上信息填写下列空白:
(1)1个X分子中,含有________个氧原子,X不可能发生的反应有________(填序号)
①加成反应 ②酯化反应 ③氧化反应 ④消去反应
(2)A分子中的官能团是(写名称)________,A的摩尔质量是________.
(3)写出④的化学方程式____________________________________________.
(4)有机物“C8H8O8”因分子组成中含有三个国人心目中的吉利数字“8”而被称为“吉利分子”.由A转化而生成的“吉利分子”有多种不同的环状结构,写出其中的含一个六元环的有机物B结构简式________________.
(5)一定量的A物质与乙醇的混合物完全燃烧生成27 g水和V L CO2(标准状况),则等物质的量该混合物完全燃烧消耗O2的物质的量为________.