下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)═CO2(g);△H1 C(s)+ O2(g)═CO(g);△H2
O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+ O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8.
| A.① | B.④ | C.②③④ | D.①②③ |
在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度C(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度C(X)随时间t变化的曲线如图所示,下列叙述正确的是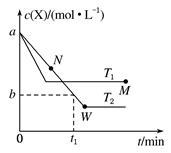
| A.该反应进行到M点放出的热量大于进行到W点放出热量 |
| B.T2下,在0~t1时间内,v(Y)= mol·L-1·min-1 |
| C.M点的正反应速率v正大于N点的逆反应速率v逆 |
| D.M点时再加入一定量X,平衡后X的转化率减小 |
化学反应N2+3H2= 2NH3的能量变化如图所示,该反应的热化学方程式是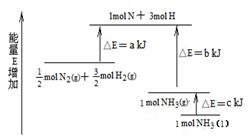
| A.N2(g)+3H2(g) = 2NH3(l)⊿H = 2(a—b—c)kJ·mol-1 |
| B.N2(g)+3H2(g) = 2NH3(g) ⊿H = 2(b—a)kJ·mol-1 |
| C.1/2N2(g)+3/2H2(g) = NH3(l) ⊿H = (b+c—a)kJ·mol-1 |
| D.1/2N2(g)+3/2H2(g) =NH3(g)⊿H = (a+b)kJ·mol-1 |
在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g) xC(g)ΔH未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
xC(g)ΔH未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)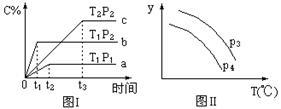
| A.P3>P4,y轴表示C的转化率 |
| B.P3<P4,y轴表示B的体积分数 |
| C.P3<P4,y轴表示混合气体的密度 |
| D.P3>P4,y轴表示混合气体的平均摩尔质量 |
已知 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
| H2(g) |
Br2(g) |
HBr(g) |
|
| 1mol分子中的化学键断裂时需要吸收的能量/KJ |
436 |
a |
369 |
则表中a为
A.404B.260C.230 D.200
如下图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)
| A.压缩后U型管内左侧液面下降,右侧液面上升 |
B.对于2NO2 N2O4平衡体系,向生成N2O4的方向移动 N2O4平衡体系,向生成N2O4的方向移动 |
| C.左侧气体颜色先变深后逐渐变浅(比原来深) |
| D.若将两侧注射器活塞重新拉到10mL的位置,平衡后U型管两侧液面仍然保持水平 |