在一定温度下,在一个密闭容器中加入H2和I2蒸气各0.5mol,发生反应H2+I2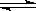 2HI,达到平衡时,生成HI 0.8 mol,若其它条件不变,开始充入的H2为2 mol,则达到平衡时生成的HI可能是下列中的
2HI,达到平衡时,生成HI 0.8 mol,若其它条件不变,开始充入的H2为2 mol,则达到平衡时生成的HI可能是下列中的
A 1.1 mol B 0.87 mol C 0.8 mol D 0.5 mol
由锌、铁、铝、镁四种金属中的两种组成的混合物10 g,与足量的盐酸反应产生的氢气在标准状况下为11.2 L,则混合物中一定含有的金属是
| A.锌 | B.铁 | C.铝 | D.镁 |
Mg、Al两种金属分别跟相同体积、相同浓度的稀H2SO4反应,同温同压下生成氢气的体积相同,则Mg、Al两种金属之间的量的关系一定正确的是
| A.两个反应转移的电子数目相等 |
| B.加入镁、铝的质量比为4:3 |
| C.金属溶解的物质的量相等 |
| D.加入的两种金属的质量不等 |
下列反应中,硝酸既表现酸性,又表现氧化性的是
| A.Fe2O3跟稀硝酸反应 |
| B.铜跟稀硝酸反应 |
| C.CuO跟稀硝酸反应 |
| D.Al(OH)3跟稀硝酸反应 |
下列物质中,常温下既能跟盐酸反应,又能跟NaOH溶液反应的是
| A.Mg | B.Al | C.Si | D.Cl2 |
常温下,下列溶液可以用铝槽车装运的是
| A.氢氧化钠溶液 | B.浓盐酸 | C.浓硝酸 | D.稀硝酸 |