由锌、铁、铝、镁四种金属中的两种组成的混合物10 g,与足量的盐酸反应产生的氢气在标准状况下为11.2 L,则混合物中一定含有的金属是
| A.锌 | B.铁 | C.铝 | D.镁 |
下列各组高分子化合物中,不论组内物质以何种比例混合,完全燃烧等质量的高分子化合物消耗氧气质量不变的是 ( )。
| A.聚乙烯、聚丙烯、聚2丁烯 |
| B.聚苯乙烯、聚异戊二烯、丁苯橡胶 |
| C.聚甲基丙烯酸甲酯、聚丙烯、聚苯乙烯 |
| D.丁苯橡胶、顺丁橡胶、天然橡胶 |
高分子材料与一般金属材料相比,优越性是 ( )。
| A.强度大 | B.导电性好 |
| C.不耐化学腐蚀 | D.不耐热 |
橡胶是重要的工业原料,具有良好的弹性,但强度较差。为了增加某些橡胶制品的强度,加工时需进行硫化处理。硫化程度越高的强度越大,弹性越差。下列橡胶制品中,加工时硫化程度较高的是 ( )。
| A.橡皮筋 | B.汽车外胎 |
| C.普通气球 | D.医用乳胶手套 |
有一种供婴儿使用的一次性纸质尿布——“尿不湿”,其中含有一层既能吸水又能保留水的物质,据你推测,该物质可能是 ( )。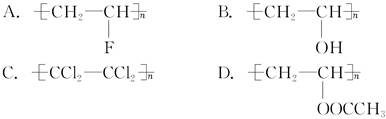
当前为减少塑料废弃物造成的污染,应采取的有效措施是 ( )。
| A.将废塑料深埋 | B.将废塑料焚烧 |
| C.将废塑料倾倒在海洋中 | D.将废塑料回收再利用 |