实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
①在天平上称出27.8g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入500mL容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2cm处.改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为(填序号) .
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是
、 .
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会 (填“偏高”、“偏低”或“无影响”).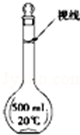
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:没有进行操作步骤④,会 ;加蒸馏水时不慎超过了刻度,会 .向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,会 .
(5)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应 .
某课外活动小组同学用下图装置进行实验,试回答下列问题: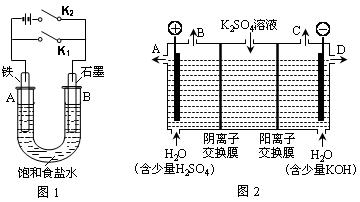
Ⅰ.以图1的实验装置进行实验。
(1)若开始时打开开关K2,闭合开关K1,则该装置为(填装置名称)。
(2)若开始时打开开关K1,闭合开关K2,则:
四校2010届高三毕业班期末联考化学试卷第7页 (共12页)
①U型管里总反应的离子方程式为
②对于上述实验,下列说法正确的是(填序号)。
| A.溶液中Na+向B极移动 |
| B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 |
| C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 |
| D.若标准状况下从A极逸出2.24L气体,则外电路上通过的电子数目略大于0.2NA |
Ⅱ.以图2的实验装置进行实验。
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为。此时通过阴离子交换膜的离子数(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液的pH会增大,请简述原因。
已知X、Y、Z、W四种元素分布在元素周期表中的三个不同短周期元素里,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)写出X、Y的元素符号:X、Y;
(2)W在元素周期表中的位置是;Z的原子结构示意图
(3)由X、Y、Z所形成的离子化合物的化学式是,它与W的最高价氧化物的水化物的溶液反应时的离子方程式是;
(4)用电子式表示Y的氢化物的形成过程。
在下列事实中,什么因素影响了化学反应速率?
(1)熔化的KClO3放出气泡很慢,加入少量MnO2后很快产生气体_____________;
(2)同浓度、同体积的盐酸放入同样大小的锌块和镁块,产生气体有快有慢_____________;
(3)夏天的食品易变霉,冬天就不易发生该现象_____________。
下列反应中,属于放热反应的是_____________,属于吸热反应的是___________。
| A.盐酸与烧碱溶液反应 |
| B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑ |
| C.氢气在氧气中燃烧生成水 |
| D.高温煅烧石灰石使其分解 |
E.铝和盐酸反应
F.葡萄糖在人体内氧化分解
已知A、B、 C、 D四种物质都含有一种共同的元素,相互转化的关系如图所示:
其中,A是一种淡黄色的固态非金属单质,B是H2S,C是一种无色有刺激性气味的气体,并能使品红溶液褪色,D是H2SO4。
(1)根据以上信息推断:A:C:(填化学式)
(2)从A、 B、 C、 D四种物质中任选一种,从他们所含共同元素的价态上预测该物质具有氧化性或还原性,并设计实验验证:
我的预测:
主要操作:
可能的现象:
化学方程式: