一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应
N2(g)+3H2(g)  2NH3(g) ΔH = -92.2kJ•mol—1,测得0到10秒内,c(H2)减小了0.75mol•L—1,下列说法正确的是( )
2NH3(g) ΔH = -92.2kJ•mol—1,测得0到10秒内,c(H2)减小了0.75mol•L—1,下列说法正确的是( )
| A.10到15秒内c(NH3) 增加量等于0.25mol •L—1 |
| B.10秒内氨气的平均反应速率为0.025mol•L—1•s—1 |
| C.达平衡后,分离出少量NH3,v正增大 |
| D.该反应的逆反应的活化能不小于92.2kJ•mol—1 |
下列各装置中都盛有0.1 mol·L-1的NaCl溶液,放置相同时间后,锌片的腐蚀速率由快到慢的顺序是()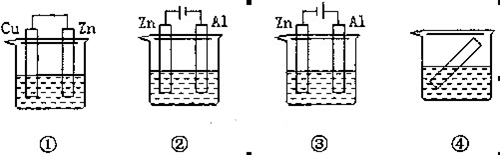
| A.③①④② | B.①②④③ | C.②①④③ | D.②①③④ |
关于如图所示装置的叙述,正确的是()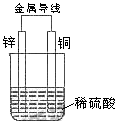
| A.铜是阳极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是()
| A.Mg 电极是该电池的正极 |
| B.H2O2在石墨电极上发生氧化反应 |
| C.石墨电极附近溶液的pH 增大 |
| D.溶液中Cl-向正极移动 |
现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸浓度为4mol/L,稀硝酸的浓度为2mol/L。取10mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收集到气体体积为(假设HNO3只被还原为NO)( )
| A.0.224L | B.0.448L | C.0.672L | D.0.896L |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是( )
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |