氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C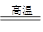 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中,每生成1molAlN需转移3mol电子 |
| C.AlN中氮元素的化合价为+3 |
| D.AlN的摩尔质量为41g |
提纯含有少量硝酸钡杂质的硝酸钾溶 液,可以使用的方法是()
液,可以使用的方法是()
| A.加入过量的碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
B. 加入过量的硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 加入过量的硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| C.加入过量的硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| D.加入过量的碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
将氯化钠、乙醇、碘分别从以下三组混合物中分离出来:①氯化钠和水②乙醇和水③碘和水,宜采取的操作方法依次是()
| A.蒸发、蒸馏、萃取 | B.萃取、蒸馏、蒸发 |
| C.蒸发、萃取、蒸馏 | D.蒸馏、萃取、蒸发 |
实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如下图。做“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是( )
甲、乙、丙、丁、戊分别是Na2SO4、Ba(NO3)2、HNO3、BaCl2、NaOH五种溶液中的一种,现利用X(一种钠盐)溶液鉴别它们。根据下图中的转化关系,下列判断错误的是()
| A.甲是BaCl2 | B.丙是Ba(NO3)2 | C.戊是Na2SO4 | D.X是Na2CO3 |
某固体混合物可能由A l、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积),下列说法正确的是()
l、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积),下列说法正确的是()
| A.混合物中一定含有Al、(NH4)2SO4和MgCl2,一定不含AlCl3、FeCl2 |
| B.混合物中一定含有Al、(NH4)2SO4和MgCl2,一定不含FeCl2,不能确定是否含有AlCl3 |
| C.所有物质是否存在均能确定,不存在无法确定的物质 |
| D.混合物中一定含有Al、(NH4)2SO4、MgCl2和AlCl3,一定不含FeCl2 |