焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取:采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
(1)装置Ⅰ中产生气体的化学方程式为 。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。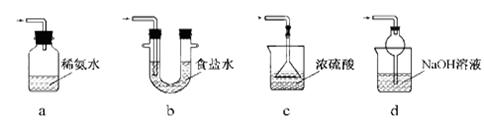
实验二 焦亚硫酸钠的性质:Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是
(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是 。
实验三 葡萄酒中抗氧化剂残留量的测定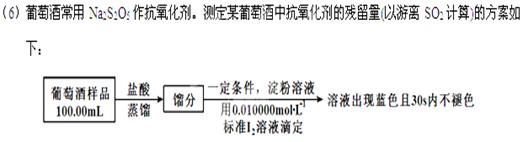
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
某化学课外小组利用下图实验装置(夹持仪器略去),探究铜与浓硝酸反应是否有NO生成。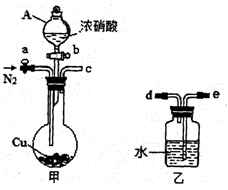
请回答下列问题:
(1)仪器A的名称是。
(2)甲装置的c应该与乙装置的连接(填“d”或“e”)。
(3)乙装置中反应的化学方程式是。
(4)实验步骤如下:
i仪器组装完毕,检查装置的气密性,加入试剂。打开旋塞a,通入N2一段时间后,关闭旋塞a。
ii打开旋塞b,滴入xmol·L-1浓硝酸V mL,充分反应后冷却,固体仍有剩余。
iii用NaOH溶液滴定乙装置中溶液,得溶质的物质的量为n mol。
①步骤i通入N2的目的是________
②为了准确测定甲装置中产生NO2的量,在步骤ii和iii之间应补充的操作是:
。
③当xV×l0-33n(填“>”、“=”或“<”),则证明铜与浓硝酸反应时有NO生成。
④该实验设计中存在一个明显的缺陷是。
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。
据此回答下列问题:
(1) 在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,若在标准状态下收集到33.6L的氯气,则被氧化的HCl的物质的量是。
(2) 漂白粉将在U形管中产生,其化学方程式是。
(3) C装置的作用是。
(4) 此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是。
②试判断另一个副反应为(用化学方程式表示)。
为避免此副反应的发生,可将装置作何改进。
(5)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是()
| A.食盐 | B.食醋 | C.烧碱 | D.纯碱 |
.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。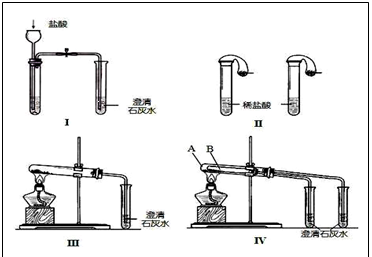
(1)只根据图I、II所示实验,能够达到实验目的是(填装置序号)___________;
(2)图III、IV所示实验均能鉴别这两种物质,其中涉及的化学反应方程式有:
、;
与实验III相比,实验IV的优点是(填选项序号)________________;
A.IV比III复杂 B.IV比III安全
C.IV可以做到用一套装置同时进行两个对比实验,而III不行
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是_________;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。当石灰水过量时,其离子方程式为。
用实验确定HCOOH是弱电解质。两同学的方案是:
甲:①称取一定质量的HCOOH配制0.1 mol·L-1的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HCOOH是弱电解质。
乙:①用已知物质的量浓度的HCOOH溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释为100 mL;③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HCOOH是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是。
(2)甲方案中,说明HCOOH是弱电解质的理由是测得溶液的pH1(选填>、<、=)。
乙方案中,说明HCOOH是弱电解质的现象是
a.装HCl溶液的试管中放出H2的速率快;
b.装HCOOH溶液的试管中放出H2的速率快;
c.两个试管中产生气体速率一样快:
(3)一定温度下有:a.盐酸;b.硫酸;c.醋酸三种酸。
①当其物质的量浓度相同时,c(H+)由大到小的顺序是___________________________。
②当c(H+)相同、体积相同时,同时加入镁,若产生相同体积的H2(相同状况),则开始时的反应速率____________________。(用a b c的大小关系表示)
中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于___________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1NaOH溶液进
行反应与上述实验相比,所放出的热量(填“相等”“不相等”),若实验操作均正确,则所求中和热填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中