用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
| A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B.0.5molO3与11.2LO2所含的分子数一定相等 |
| C.28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| D.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
向等体积等物质的量浓度的H2S和SO2的水溶液各两份中,分别通入Cl2和O2,一段时间后,右图表示通入的气体的量与溶液pH关系的曲线图,下列说法中正确的是()
A.曲线a表示向H2S水溶液中通入O2 |
B.曲线b表示向SO2水溶液中通入O2 |
C.曲线c表示向H2S水溶液中通入Cl2 |
D.曲线d表示向SO2水溶液中通入Cl2 |
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是()
A.蓝色石蕊试纸先变红后褪色 |
B.品红试纸、沾有KMnO4溶液滤纸均褪色证明了 SO2漂白性 SO2漂白性 |
C.湿润淀粉KI试纸未变蓝说明SO2的氧化性弱于I2 |
D.NaCl溶液可用于除去实验中多余的SO2 |
高温下硫酸亚铁发生如下反应:2FeSO4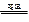 Fe2O3+SO2↑+SO3↑若将生成的气体通入氯化钡溶液中,得到的沉淀是( )
Fe2O3+SO2↑+SO3↑若将生成的气体通入氯化钡溶液中,得到的沉淀是( )





| A.BaSO3和BaSO4 | B.BaS |
C.BaSO3 | D.BaSO4 |
实验室有一瓶久置的白色K2SO3粉末,为确定其是否被氧化及其成分,元素分析表明粉末中K和S元素的质量比为39∶16,下列结论正确的是()
A.根据元素分析结果推测该粉末为纯净物 |
B.将粉末溶于水,加入氯化钡,有白色沉淀生成,证明原粉末是K2SO4 |
C.将粉末加入盐酸中,产生气泡,证明原粉末是K2SO3 |
D.将粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成,证明原粉末是K2SO4和K2SO3的混合物 |
研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下: ①SO2+N2O5
①SO2+N2O5 SO3+NO ②SO3+H2O
SO3+NO ②SO3+H2O H2SO4 ③2NO+O2
H2SO4 ③2NO+O2 2NO2
2NO2 NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是()
NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是()
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 |
B.硫化氢通入浓H2SO4 |
C.浓H2SO4滴入萤石中,加热 |
D.加入少量的H2SO4使乙酸乙酯水解 |