0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3处理,产生0.02mol AgCl沉淀,此氯化铬最可能是( )
| A.[Cr(H2O)6]Cl3 | B.[Cr(H2O)5Cl]Cl2·H2O |
| C.[Cr(H2O)4Cl2]Cl·2H2O | D.[Cr(H2O)3Cl3]·3H2O |
已知可逆反应N2O4(g) 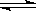 2NO2(g)在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
2NO2(g)在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
| A.由于K2>K1,所以a>b |
| B.由于K随温度升高而增大,所以此反应的△H>0 |
| C.由于K随温度升高而增大,所以此反应的△H<0 |
| D.其它条件不变时,将盛有该混合气体的容器置于热水中,体系颜色变浅 |
在一真空密闭容器中,充入10 mol N2和30 mol H2,发生N2+3H2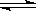 2NH3反应,在一定温度下达到平衡时,H2的转化率为25%。若在同一容器中在相同温度下充入NH3,欲达到平衡时各成分的百分含量与上述平衡相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率
2NH3反应,在一定温度下达到平衡时,H2的转化率为25%。若在同一容器中在相同温度下充入NH3,欲达到平衡时各成分的百分含量与上述平衡相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率
| A.15 mol、25% | B.20 mol、50% | C.20 mol、75% | D.40 mol、80% |
下列有关工业上制硫酸和氨气的说法不正确的是
| A.硫酸工业中制SO3的反应条件是:高温、高压、催化剂 |
| B.合成氨气的条件是:400—500 ℃、10Mpa —30 MPa、铁触媒 |
| C.都进行了循环操作 |
| D.都有热交换装置 |
物质的量浓度相同的下列溶液,pH由大到小排列正确的是
| A.Ba(OH)2、Na2SO3、FeCl3、KCl | B.Na2CO3、NaHCO3、KNO3、NH4Cl |
| C.NH3·H2O、H3PO4、Na2SO4、H2SO4 | D.NaCl、H2SO3、NH4NO3、NaHSO4 |
将1 mol H2(g)和2 mol I2(g)置于某2 L密闭容器中,在一定温度下发生反应:H2(g)+ I2(g)  2HI(g)△ H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示。若改变反应条件, ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是
2HI(g)△ H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示。若改变反应条件, ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是 
| A.恒温恒容条件下,加入适当催化剂 |
| B.恒温条件下,缩小反应容器体积 |
| C.恒容条件下升高温度 |
| D.恒温条件下,扩大反应容器体积 |