卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)卤族元素位于周期表的_________区;溴的电子排布式为______________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合的作用力是 。
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 。
| |
氟 |
氯 |
溴 |
碘 |
铍 |
| 第一电离能 (kJ/mol) |
1681 |
1251 |
1140 |
1008 |
900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4(填“>”、“<”或“=”)
(5)已知ClO2-立体构型为V型。ClO2-中心氯原子的杂化轨道类型为___________,写出CN-的等电子体的化学式__________(写出1个)
(6)下图为碘晶体晶胞结构。有关说法中正确的是_____________。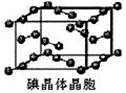
A、用均摊法可知平均每个晶胞中有4个碘原子
B、碘晶体为无限延伸的空间结构,是原子晶体
C、碘晶体中存在非极性键和范德华力
同温同压下,同体积的氨气和硫化氢(H2S)气体的质量比为______________;同质量的氨气和硫化氢(H2S)气体的体积比为__________________,所含原子个数比为
_____________;若两者所含氢原子数相等,它们的物质的量比是__________________。
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是。
(3)把KI换成KBr,则CCl4层变为__色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2L(标准状况,保留2位小数)。
已知CO和CO2的混合气体14.4g在标准状况下所占的体积为8.96L。则该混合气体中,CO的质量为_____g,CO2的物质的量为_____mol。
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g· mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为_______个。
(3)该气体在标准状况下的体积为_________L。
(4)该气体溶于1L水中(不考虑反 应),其溶液中溶质的质量分数为______。
应),其溶液中溶质的质量分数为______。
将铜片投入盛有稀硫酸的试管中无反应。当加入少量硝酸钾晶体后,试管内产生一种无色气体,这种气体在试管口变成红棕色。这种无色气体是__________。写出有关的离子反应方程式.________________________________________________________