计算以下两小题时,除必须应用所有给出的数据外,还各缺少一个数据,指出该数据的名称(分别以a和b表示),并列出计算式。
(1)在标准状况下,19.5g A与11.0g B恰好完全反应,生成固体C和3.00L的D气体,计算生成的C 的质量(m)。缺少的数据是 ,
计算式为m= 。
(2)足量金属镁与10mL盐酸反应,计算生成的H2在标准状况下的体积[V(H2)]。缺少的数据是 ,计算式为
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。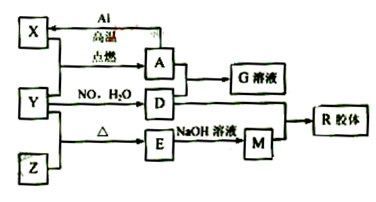 回答下列问题:
回答下列问题:
(1)组成单质X的元素在周期表中的位置是;M中存在的化学键类型为;
(2)一定条件下,Z与H2反应生成ZH4的结构式为。
(3)已知A与1molAl反应转化为X时(所有物质均为固体)。放出aKJ热量。写出该反应的热化学方程式:。
(4)写出M和D的稀溶液反应生成R的离子方程式:
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。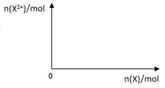
某澄清透明溶液中,可能含有NH4+、Mg2+、Al3+、Fe2+、Br—、SO42—、NO3—、CO32—等离子的一种或几种,进行下列实验: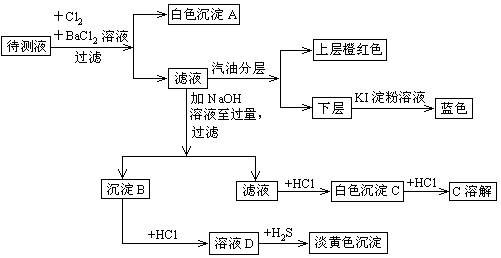
根据实验结果回答:
⑴溶液中肯定有的离子是___________。
⑵判断待测溶液中有无CO32—,并说明理由________________________________。
⑶沉淀B肯定有什么物质___________,生成淡黄色沉淀的离子方程式 ___________。
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
能形成双原子气体分子,原子中有三个单电子 |
| X |
核外有5个能级,最高能级上只有1个电子 |
| Y |
最外层电子数是次外层电子数2倍 |
| Z |
最高正价为+7价 |
(1)写出元素Z的离子结构示意图__________。另有某元素M在地壳中的含量仅次于X,写出其+2价阳离子的电子排布式。
(2)X的硫酸盐与过量氢氧化钡反应的离子反应方程式为__________。
(3)COZ2俗称光气,其中碳氧原子之间的共价键有个σ键,个π键
(4)TH3的空间构型为 。(填“难”或“易”)溶于CCl4。
某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mgMg2+,则Mg2+的物质的量浓度为。
12.4gNa2X中含Na+0.4mol,则Na2X的摩尔质量是,X的相对原子质量是。