下面是合成氨的简要流程示意图: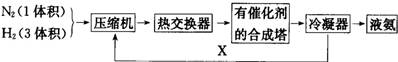
沿X路线回去的物质是( )
| A.N2和H2 | B.催化剂 | C.N2 | D.H2 |
一定条件下有可逆反尖:x(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),达到平衡时X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断中不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),达到平衡时X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断中不合理的是
| A.c1:c2="1:3" | B.平衡时,Y和Z的生成速率之比为3:2 |
| C.X、Y的转化率相等 | D.c1的取值范围为0<c1<0.1mol·L-1 |
已知:4NH3+5O2===4NO+6H2O,若反应速率分别用v(NH3) 、v(O2) 、v(NO) 、v(H2O)[来(mol·L-1· min-1)表示,则正确的关系是
min-1)表示,则正确的关系是
A.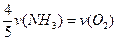 |
B.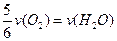 |
C.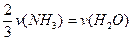 |
D.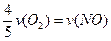 |
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入 以磷酸为电解质溶液的燃料电池中发电,电池正极反应为
以磷酸为电解质溶液的燃料电池中发电,电池正极反应为
| A.H2+2OH--2c-===2H2O | B.O2+4H++4e-===2H2O |
C.H2-2e-====2H+ |
D.O2+2H2O+4e-===4OH- |
一定量的H2在一定条件下完全燃烧后,生成气态H2O,放出热量Q1,等质量的H2在相同条件下完全燃烧生成液态H2O,放出热量Q2,则Q1和Q2的关系是
| A.Q1> Q2 | B.Q1=Q2 | C.Q1<Q2 | D.无法确定 |
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用,锌—锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。下列说法中错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为2MnO2(s)+H2O(l)+2e-===Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g |