下列说法正确的是( )
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 |
| B.铁片镀锌时,铁片与外电源的正极相连 |
| C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 |
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g) NO(g)+SO3(g),通入少量O2, NO(g)+SO3(g),通入少量O2, 的值及SO2转化率不变 的值及SO2转化率不变 |
下列离子方程式书写正确的是()
| A.铜溶于浓硝酸: Cu +4HNO3 (浓)=Cu2+ + 2NO2↑+2H2O |
| B.硫酸铁溶液与氢氧化钡溶液混合: Fe3++SO42—+Ba2++3OH—=Fe(OH)3↓+BaSO4↓ |
| C.次氯酸钙溶液中通入过量的CO2: ClO—+H2O+CO2=HCO3—+HClO |
| D.碳酸氢镁与足量的石灰水反应: |
Mg2++2HCO3—+2OH—+Ca2+=CaCO3↓+MgCO3↓+2H2O
右表为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中,正确的是()
A.常压下,五种元素的单质中 ,Z单质的沸点最高
,Z单质的沸点最高
B.W的氢化物比X的氢化物的稳定性高
C.Y、Z的阴离子电子层结构都与B原子的相同
D.Y元素比W元素的非金属性强
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是()
| A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl- |
| B.x=0.6a,2Br-+ Cl2=Br2+2Cl- |
| C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- |
| D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- |
氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是()
| A.一个D2O分子所含的中子数为8 | B.NH3的结构式为H— —H —H |
C.HCl的电子式为H+[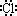 ] ] |
D.热稳定性:H2S>HI |
航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4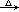 N2↑+4H2O+Cl2↑+2O2↑+Q。下列对此反应的叙述中错误的是()
N2↑+4H2O+Cl2↑+2O2↑+Q。下列对此反应的叙述中错误的是()
| A.上述反应中,每生成1molN2则转移电子6mol |
| B.上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C.反应从能量变化上说,主要是化学能转变为热能和动能 |
| D.在反应中高氯酸铵既起氧化剂,又起还原剂作用 |