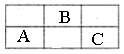
短周期元素A、B、C在周期表中所处的位置如表所示。A、B、C三种元素原子的质子数之和为37,回答下列问题:
(1)与A元素同周期且金属性最强的元素原子的结构示意图为 。实验室可用无水乙醇处理少量残留的该金属单质,化学方程式为________________,该反应的基本反应类型是_________。
(2)列举一个事实说明C非金属性强于A: ______________(用化学方程式表示)。要清洗附着在试管壁是的C单质,可选用的试剂是___________。
(3)已知:①C(s)+O2(g)=CO2(g) △H=akJ·mol-1;②CO2(g) +C(s)=2CO(g) △H=b kJ· mol-1;③A(s)+ O2(g)=AO2(s) △H=ckJ·mol-1。工业上生产A的热化学方程式为____________(用相应的符号表示,下同)。
(4)NaBO2是B元素形成的一种含氧酸盐,某同学把新制的氯水加到NaBO2溶液中,观察到氯水褪色,同时生成B的另一种含氧酸盐NaBO3和HCl,请写出反应的离子方程式:_______________。
(5)已知饮用水中的BO3- 对人类健康会产生危害,为了降低饮用水中BO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将BO3-还原为B2,请配平化学方程式:
10Al+6NaBO3 + 4NaOH + 18H2O=□ ________ + 3B2↑。
若生成标况下的B2体积为5.6L,则反应过程中转移电子的物质的量为________。
(14分)请回答下列问题:
(1)下表列出了一些化学键的键能E:
| 化学键 |
H—H |
O===O |
O—H |
| E/kJ·mol-1 |
436 |
x |
463 |
反应H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
(2)铅蓄电池是正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液,电池放电时的总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
请写出充电时阴极的电极反应式:__________________
(3)反应m A+n B p C,在某温度下达到平衡。
p C,在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是________________。
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向________________方向移动。
③若再升高温度,平衡向逆向移动,则正反应为 _________ 反应(填“吸热”或“放热”)
(4)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如图所示。
①请在图中标出电极材料及电解质溶液(写化学式)________________
②盐桥中的Cl-向________极移动(填“左”或“右”)。
金属铁是应用广泛,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取3.25g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用1.0 mol·L-1的盐酸中和滴定,正好中和时消耗盐酸60.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值:
(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.8,则该样品中FeCl3的物质的量分数为 。
(3)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,其中Zn极的电极反应式为 ,K2FeO4的电极反应式为 。
硫及其化合物在工业生产中有重要的应用,它们性质的研究对工业生产有重要的指导意义。
(1)2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。
2SO3(g),反应过程的能量变化如图所示。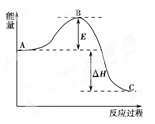
已知1 mol SO2(g)氧化为1 mol SO3(g)放出的热量为99 kJ。请回答下列问题:
①图中E表示_____________,E的大小对该反应的反应热有无影响?_______________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________,理由是_____________;
②图中ΔH=____________kJ·mol-1;
(2)下图表示在密闭容器中反应2SO2+O2 2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。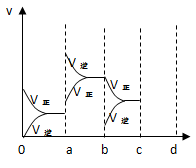
①a b过程中改变的条件可能是 ;
②b c过程中改变的条件可能是 ;
③若增大压强时,反应速率变化情况画在c~d处。
分,共反应mA+nB pC在某温度下达到平衡。
pC在某温度下达到平衡。
(1)若A、B、C都是气体,减压后v正小于v逆,则m、n、p的关系是______ 。
(2)若在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为___________态。
(3)若A为液体,C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向________(填“正反应”或“逆反应”)方向移动。
(4)若升高温度,A物质的转化率增大,则该反应为________(“吸热”或“放热”)反应。
(1)化学反应N2+3H2= 2NH3的能量变化如图所示,该反应的热化学方程式是:N2(g)+3H2(g) = 2NH3(l);⊿H =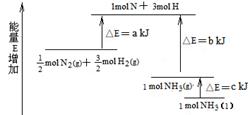
(2)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式 。
(3)已知:反应H2(g) + Cl2(g) = 2HCl(g) ΔH=" —184" kJ/mol
4HCl(g)+O2(g)  2Cl2(g)+2H2O(g)ΔH=" —115.6" kJ/mol
2Cl2(g)+2H2O(g)ΔH=" —115.6" kJ/mol
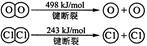
请回答:
H2与O2反应生成气态水的热化学方程式
断开1 mol H—O 键所需能量约为 kJ