近年来,碳和碳的化合物在生产生活实际中应用越来越广泛。
(1)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。已知某反应的平衡常数表达式为:K= ,它所对应的化学方程式为: 。
,它所对应的化学方程式为: 。
(2)甲醇是一种重要的化工原料,在日常生活中有着广泛的应用。工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为_________________。
(3)在Cu2O/ZnO做催化剂的条件下,将1molCO(g)和2molH2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如下图所示。

根据题意回答下列问题:
①正方应是______反应(填“放热”或“吸热”);500℃时平衡常数K= 。
②在300℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法正确的是 。
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加 d.重新平衡时n(H2) /n(CH3OH)增大
④据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是: (写出相关的化学方程式并辅以必要的文字说明)。
(3)甲烷是一种清洁能源,也可用于燃料电池。某甲烷燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见下图)。A物质的化学式是_________;该原电池的负极反应式可表示为 。
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2 + O2 2NO,是导致汽车尾气中含有NO的原因之一,科学家设计利用NH3在催化条件下将NOx还原成N2而排放。
2NO,是导致汽车尾气中含有NO的原因之一,科学家设计利用NH3在催化条件下将NOx还原成N2而排放。
①在T1、T2温度下,一定量的NH3发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ 3H2(g) 2NH3(g)的△H_______0(填“>”或“<”)。
2NH3(g)的△H_______0(填“>”或“<”)。
②在 温度下,向2L密闭容器中充入10molN2与5mo1H2,50秒后达到平衡,测得NH3的物质的量为2mol,则该反应的速率v(N2)___________________。该温度下,若增大压强此反应的平衡常数将_______________(填“增大”、“减小”、“不变”或“无法确定”);若开始时向上述容器中充入N2与H2均为10 mol,则达到平衡后H2的转化率将__________。(填“升高”、“降低”)
温度下,向2L密闭容器中充入10molN2与5mo1H2,50秒后达到平衡,测得NH3的物质的量为2mol,则该反应的速率v(N2)___________________。该温度下,若增大压强此反应的平衡常数将_______________(填“增大”、“减小”、“不变”或“无法确定”);若开始时向上述容器中充入N2与H2均为10 mol,则达到平衡后H2的转化率将__________。(填“升高”、“降低”)
(2)利用图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。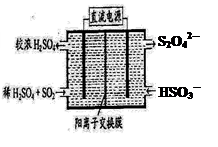
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L-1的醋酸与b mol L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_________(用含a和b的代数式表示)。
L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_________(用含a和b的代数式表示)。
请根据化学学科中的基本理论,回答下列问题
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。火法还原CuO可制得Cu2O.已知:1克C(s)燃烧全部生成CO时放出热量9.2kJ;Cu2O(s)与O2(g)反应的能量变化如图1所示;请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式
(2)在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2和H2O.该反应的化学方程式为______
(3)某兴趣小组同学以纳米级Cu2O催化光解水蒸气并探究外界条件对化学平衡的影响.
①在体积均为1L,温度分别为T1、T2的A、B两密闭容器中都加入纳米级Cu2O并通人0.1mol水蒸气,反应:2H2O(g)⇌2H2(g)+O2(g)△H=+484kJ•mol-1经测定A、B两容器在反应过程中发生如图2所示变化,则A、B两容器反应的温度T1________T2(填“<”、“=”或“>”),该过程中A容器至少需要吸收能量________kJ
②当该反应处于平衡状态时,下列既能增大反应速率,又能增大H2O(g)分解率的措施是(填序号)_________.
A.向平衡混合物中充入Ar B.升高反应的温度
C.增大反应体系的压强 D.向平衡混合物中充人O2
(4)25℃时,H2SO3═HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数Kh=_________mol/L.
(1)二氧化硅与碳高温下反应的化学方程式为
上述反应中生成的单质有什么用途: (写一条即可)。卞石是硅酸盐,不同类型的卞石中氧原子的物质的量分数相同,由钠卞石化学式NaAlSi3O8可推知钙卞石的化学式为 ,请将钠卞石的化学式改写成氧化物的形式:
(2)天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去):
COS Na2S溶液
Na2S溶液 H2羰基硫分子的电子式为 。反应I除生成两种正盐外,还有水生成,其化学方程式为 。已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32﹣,则II中主要反应的离子方程式为 。
H2羰基硫分子的电子式为 。反应I除生成两种正盐外,还有水生成,其化学方程式为 。已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32﹣,则II中主要反应的离子方程式为 。
(1)如图所示为硝酸铜晶体[Cu(NO3)2·nH2O]的溶解度曲线(温度在30 ℃前后对应不同的晶体),从图中获取如下信息,不正确的有 (填字母)。
a.C点溶液为Cu(NO3)2的不饱和溶液
b.30℃时结晶可析出两种晶体
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.将A点溶液升温至30 ℃时,可以析出
Cu(NO3)2·3H2O晶体
(2)某些共价化合物(如H2O、NH3、N2O4等)在液态时发生了微弱的电离,如:
2H2O OH-+H3O+,则液态NH3电离的方程式是
OH-+H3O+,则液态NH3电离的方程式是
(3)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g) CO2(g) + 3H2(g)
CO2(g) + 3H2(g) H(298K)=+ 49.4 kJ/mol
H(298K)=+ 49.4 kJ/mol
该条件下反应达平衡状态的依据是(填序号) 。
| A.v正(CH3OH)=v正(CO2) |
| B.混合气体的密度不变 |
| C.c(CH3OH)=c(H2O) |
| D.混合气体的总物质的量不变 |
(4) 甲、乙两容器体积相等,甲容器通入1 mol SO2和1 mol O2,乙容器通入1 mol SO3和0.5 mol O2,发生反应:2SO2(g) + O2 (g)  2SO3(g)
2SO3(g) H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b 1(填“﹤”、“﹥”或“=”) 。
H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b 1(填“﹤”、“﹥”或“=”) 。
(5)甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。下图是甲醇燃料电池模型,试回答下列问题:
①写出该燃料电池的负极反应式 。
②空气应该从 (选a、b、c、d)通入。 M、N是阴离子交换膜,则阴离子移动的方向是 (填“从左到右”或“从右到左”)
(6)含Al3+的盐常用作净水剂,用离子方程式表示其净水原理_________。
(1)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在abc装置中能保护铁的是 (填字母)
②若用d装置保护铁,X极的电极材料应是 (填名称)
 |
(2)25℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe (OH)3]=2.64×10-39
25℃时,向含有Mg2+,Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH =" a" kJ·mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ·mol-1
(3)已知:①Fe2O3(s)+ 3C(石墨) = 2Fe(s)+3CO(g)ΔH1=" +" 489.0 kJ·mol-1
②C(石墨)+CO2(g)= 2CO(g)ΔH2 =" +" 172.5 kJ·mol-1则a = kJ·mol-1。
(4)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(5)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 |
CO[ |
Fe |
CO2 |
|
| 甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
| 乙/mol |
1.0 |
2.0 |
1.0 |
1.0] |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2∶3