有A、B、C、D、E五种前四周期元素,原子序数依次增大,A元素一种同位素常用于文物年代测定,C元素的单质之一为淡蓝色气体,可阻挡对人体有害的紫外线,D为前四周期元素中电负性最小的元素,E原子核外最外层电子数与D相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C三种原子的第一电离能由大到小的顺序为______(用元素符号表示)。
(2)基态E+离子的核外电子排布式是 ,E的高价离子与B的最常见氢化物形成的配离子的化学式为 。
(3)化合物B2C与A元素的最高价氧化物互为等电子体,则化合物B2C的立体构型是 。
(4)化合物甲由C、D两种元素组成,其晶胞如甲图,甲的化学式___________。
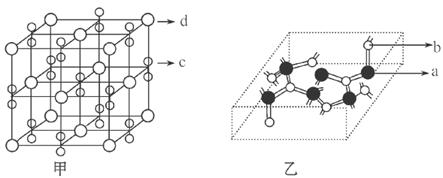
(5)化合物乙的部分结构如乙图,乙由A、B两元素组成,硬度超过金刚石。
①乙的晶体类型为________,其硬度超过金刚石的原因是______________。
②乙的晶体中A、B两种元素原子的杂化方式均为___________________。
(1)有四种钠的化合物,根据下列反应式判断W、X、Y、Z的化学式。
W,X,Y,Z。
①W→X+CO2↑+H2O ②Z+CO2→X+O2
③Z+H2O→Y+O2↑ ④X+Ca(OH)2→Y+CaCO3↓
(2)A、B、C、D、E五种物质的焰色反应都显黄色。A、B与水反应都有气体产生,A与水反应放出的气体有氧化性,B与水反应放出的气体有还原性,同时都生成C的溶液。C与适量的CO2反应生成D,D的溶液与过量的CO2反应生成E的溶液,E加热又变为D。填写下列空白:
①B与水反应的化学方程式:。
②D的溶液与过量的CO2反应生成E的溶液反应的化学方程式:。
已知有以下物质相互转化。试回答: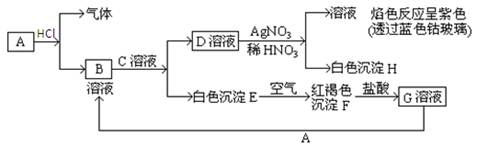
(1)写出A的化学式,B的化学式,D的化学式,F的化学式。
(2)写出由D转变成H的化学方程式。
(3)写出向G溶液加入A的有关离子反应方程式。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其余的均为短周期主族元素; ②Y原子价电子排布msnmpn ③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z的元素符号为_______,在周期表中的____分区。
(2)向Z的硫酸盐的溶液中逐滴加入R的氢化物的水溶液至过量,可观察到的现象为___________.此时Z2+与R的氢化物形成了配位数为4的配合物离子,该离子中化学键的类型有(填序号)。
A配位键 B极性共价键 C 非极性共价键 D 离子键
(3)氢化物的沸点:X的比同族其它元素高的原因是。Q和Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是_____(填序号)。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、X的第一电离能由小到大的顺序为_______________。R、X、Y四种元素的原子半径由小到大的顺序为________(均用元素符号表示)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为_____。
A、B、C、D、E、F、G均是原子序数小于36的元素。A的基态原子外围电子排布式为3s2;B原子的L电子层的P能级上有一个空轨道; C元素的基态原子最外层有3个未成对电子,次外层有2个电子; D 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2。
根据信息回答下列问题:
(1)C的外围电子排布图为。C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为;分子的VSEPR模型名称为;阴离子的立体构型为_____。
(2)G的价电子排布式为。用电子式表示化合物AE2的形成过程。
(3)F与BD易形成配合物F(BD)5,在F(BD)5中F的化合价为_______;与BD分子互为等电子体的分子和离子分别为 和 (填化学式)。
(4)E有多种含氧酸根①EO-②EO2-③EO3-④EO4-,其中空间构型为四面体型的是。(填序号)
(5)B、C、D、E原子相互化合形成的分子有多种,请列举两种分子内所有原子都满足最外层8电子稳定结构的分子:______________________(写分子式)
前四周期元素X、Y、Z、W核电荷数依次增加,并且X、Y、Z的核电荷数之和为32;Y原子基态时被电子占据的轨道有9个,其中6个被电子占满;非金属元素Z的 M层上成对电子与未成对电子所占据的原子轨道数相等;W3+离子的3d轨道中有10个电子。
(1)W基态原子的电子排布式为_____________
(2)Y可与X形成只含一个中心原子的共价化合物a,其电子式是__________;中心原子的价层电子对数为_______;a分子的立体构型是____________
(3)Z的低价氧化物既氧化性又有还原性,请分别举例说明____ _、_______(写化学方程式)。
(4)Y4分子的键角是。我们还学过了很多与Y4空间构型相同但键角不同的分子,请列举一种分子(写电子式)