把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题: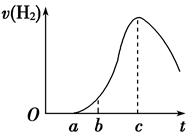
(1)曲线由O →a段不产生氢气的原因是___________________________________
有关反应的化学方程式为_________________________________
(2)曲线a→c段,产生氢气的速率增加较快的主要原因是_________________________
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是_________________________
(4)该反应若使用催化剂,可使H2产量增多吗______________(填“会”或“不会”)。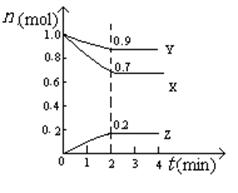
(5)某温度时,在2L密闭容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
由图中的数据分析,该反应的化学方程式为 。
反应从开始至2min末,Z的平均反应速率为 。
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)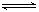 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0[ |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)= υ逆(H2O) d.c(CO2)= c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)= c(CO)·c(H2O),试判断此时的温度为℃。
已知:① N2 (g) + 3H2 (g)  2NH3 (g) ΔH=-92.4 kJ/mol
2NH3 (g) ΔH=-92.4 kJ/mol
② 2H2 (g)+ SO2 (g)  S (g) + 2H2O (g)ΔH =+90.4 kJ/mol
S (g) + 2H2O (g)ΔH =+90.4 kJ/mol
③ 2H2 (g) + CO (g)  CH3OH (g) ΔH=-90.8 kJ/mol
CH3OH (g) ΔH=-90.8 kJ/mol
请回答:
(1)上述变化过程中放出热量的是(填序号,下同),吸收热量的是。
(2)4 g H2 (g) 完全反应生成甲醇气体时,ΔH =kJ/mol。
(3)生成1 mol NH3 (g) 的放出的热量为kJ。
写出下列电解质的电离方程式:
CH3COOH
NaOH
NaHSO4
NaHCO3
铜和浓硫酸发生反应的化学方程式为:Cu +2H2SO4(浓)="=" CuSO4+SO2↑+2H2O,其中铜元素的化合价_______(填“升高”或“降低”),被_________(填“氧化”或“还原”,下同);浓H2SO4作_________剂,具有性。在该反应中,若消耗了1 mol Cu,则生成_______mol SO2。
氧化铝是一种性氧化物,它与氢氧化钠溶液反应的离子方程式为。实验室制取Al(OH)3的化学方程式______________________________,离子方程式为用氨水而不用氢氧化钠溶液的主要原因是。