铜和浓硫酸发生反应的化学方程式为:Cu +2H2SO4(浓)="=" CuSO4+SO2↑+2H2O,其中铜元素的化合价_______(填“升高”或“降低”),被_________(填“氧化”或“还原”,下同);浓H2SO4作_________剂,具有 性。在该反应中,若消耗了1 mol Cu,则生成_______mol SO2。
利用废的生铁丝(表面有铁锈)、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下图: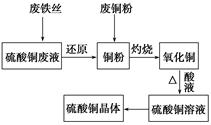
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,其目的是__________________,可能发生反应的离子方程式有Fe+2H+=Fe2++H2↑、_____________________、__________________。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO未被还原。还原剂是_______________。
(3)为了使灼烧后的混合物充分酸溶,在加入稀H2SO4的同时,也加入适量的H2O2溶液,并控温在50~60℃,持续反应1h。请回答下列问题:
①反应时温度必须控制在50~60℃,温度不宜过高,这样操作的目的_____;
②写出反应的化学方程式:_____________、________________________________。
(4)由硫酸铜溶液得到硫酸铜晶体的实验操作为________________________。
(5)直接向灼烧后的混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是_________________。
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s)△H=-75.56 kJ·mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g) SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=。
(3)从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向。将CO2转化为甲醇的热化学方程式为:CO2 (g)+3H2(g) CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①取五份等体体积CO2和H2的的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇反应的△H30(填“>”、“<”或“=”)。
②在容积为1L的恒温密闭容器中充入1molCO2和3molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下左图所示。若在上述平衡体系中再充0.5molCO2和1.5mol水蒸气(保持温度不变),则此平衡将移动(填“向正反应方向”、“不”或“逆反应方向”)。

③直接甲醇燃料电池结构如上右图所示。其工作时负极电极反应式可表示为。
向2L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示[t0~15 s阶段n(B)未画出]。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段所改变的外界条件均不同。已知t3~t4阶段为使用催化剂。观察下图,回答以下问题:
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为____________________。
(2)图乙中t2时引起平衡移动的条件是______,t5时引起平衡移动的条件是_______。(填序号)
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.减少体系压强
(3)图乙中表示平衡混合物中,在这四个阶段中C的物质的量最高的一段时间是______。(填序号): A.15s-t2时段 B.t3-t4时段 C.t4-t5时段 D.t6以后
(4)该反应的化学方程式可以表示为:_______________________________________________________,
正反应为______________(填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为________________。
工业上合成氨的热反应方程式如下:N2(g)+3H2(g) 2NH3(g)△H=-92 kJ/mol
2NH3(g)△H=-92 kJ/mol
(1)若已知破坏1mol 键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为kJ。
键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为kJ。
(2)在恒温恒压的条件下,将2mol N2和6molH2通入一容积可变的容器中反应,达到平衡后气体的体积为反应前的75%,则该过程释放的能量为kJ,氮气的转化率为,平衡后氨气占混合气体的体积分数为。
(3)若将1mol N2和1molH2通入两个相同体积的密闭容器甲和乙中,甲容器保持温度和体积不变,乙容器保持温度和压强不变,经过一段时间后,两容器均达到平衡状态。
①建立平衡所需的时间:甲乙(填“>”,“<”或“=”)
②达到平衡后氨气的体积分数:甲乙(填“>”,“<”或“=”)
如图为电解装置,X、Y为电极材料,a为电解质溶液。
(1)若a为含有酚酞的KCl溶液,X为Fe,Y为石墨,电解一段时间后:
X电极附近可观察到的实验现象是;
写出Y电极的电极反应式。
(2)若要实现Cu +H2SO4=CuSO4+H2↑,
则Y电极材料是;
写出X电极的电极反应式。
(3)若要利用该装置在铁制品表面镀上一层银,则a为,反应前两电极的质量相等,反应后电极质量相差2.16g,则该过程理论上通过电流表的电子数为。
(4)若X、Y均为惰性电极,a为NaOH溶液,电解一段时间后,溶液的pH(填“增大”“不变”“减小”),若要使溶液恢复原来的状态,可往溶液中加入。