海水资源丰富,海水中主要含有 等离子。合理利用海水资源和保护环境是我国可持续发展的重要保证。
等离子。合理利用海水资源和保护环境是我国可持续发展的重要保证。
Ⅰ.火力发电燃煤排放的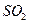 会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示: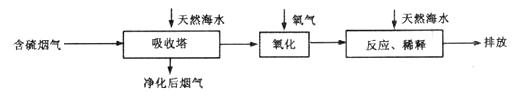
(1)天然海水显碱性的原因是(用离子方程式表示): 。
(2)天然海水吸收了含硫烟气后,要用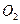 进行氧化处理,其反应的化学方程式是__________________________;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是___________________________。
进行氧化处理,其反应的化学方程式是__________________________;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是___________________________。
Ⅱ.重金属离子对河流及海洋造成严重污染。某化工厂废水(pH=2.0,ρ≈1g·mL-1)中含有 等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 |
 |
 |
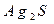 |
 |
 |
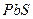 |
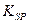 |
8.3×10-17 |
5.6×10-8 |
6.3×10-50 |
7.1×10-9 |
1.2×10-15 |
3.4×10-28 |
(3)你认为往废水中投入_________(填字母序号),沉淀效果最好。
A. |
B.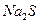 |
C. |
D.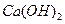 |
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中 =_______。
=_______。
(5)如果用食盐处理其只含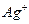 的废水,测得处理后的废水中
的废水,测得处理后的废水中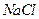 的质量分数为0.117%。若环境要求排放标准为
的质量分数为0.117%。若环境要求排放标准为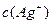 低于1.0×l0-8mol·L-1,问该工厂处理后的废水中
低于1.0×l0-8mol·L-1,问该工厂处理后的废水中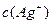 =___,是否符合排放标准_____(填“是”或“否”)。
=___,是否符合排放标准_____(填“是”或“否”)。
已知 =1.8×l0-10
=1.8×l0-10
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,C为 (写元素符号)。
(2)写出A、B的化合物与E反应的化学方程式:
。
(3)A、B两元素形成化合物属 (“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:
。
下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式回答以下问题:
| 主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
(1)在这些元素中,最活泼的非金属元素是 化学性质最不活泼元素原子的原子结构示意图为 ;
(2)元素的最高价氧化物对应的水化物中酸性最强的酸是,
呈两性的氢氧化物是;
(3)最强碱的电子式为:_____________①的气态氢化物的电子式:_____________________
④和⑦所形成化合物的电子式:________________________。
(4)在⑦与⑩的单质中,化学性质较活泼的是,可用什么化学反应说明该事实(写出反应的化学方程式):。
现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
| ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
| 原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
| 最高或最低化合价 |
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
| -2 |
-3 |
-1 |
-3 |
回答下列问题:
(1)③的元素符号是,⑧的元素名称是。①在元素周期表中的位置是(周期、族)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是,
名称是;碱性最强的化合物的电子式是:;该化合物中含有的化学键(选填“离子键”、“极性共价键”、“非极性共价键”)
(3)比较④和⑦的氢化物的稳定性(用化学式表示)。
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:
。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:
。
用A+、B-、C2―、D、E、F、G分别表示含有18个电子的7种微粒(离子或分子),请回答:
(1)A元素是、B元素是、C元素是(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其单质在常温下呈浅黄绿色,分子式是。
(4)F是由两种元素组成的三原子分子,其结构式是。
(5)G分子中含有4个原子,其分子式是。
下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,F是海水中含有盐的主要成分,J为D、G反应产物形成的水溶液。
请回答下列问题:
(1)B的化学式为____________。
(2)H的电子式为____________。
(3)写出反应③的离子方程式 。
(4)写出反应④的化学方程式 。