26A、B、C、D、E、F是五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应。请回答下列问题:
(2)写出C、D两种元素形成的原子个数比为1:1的物质的含有的化学键为 。
(3)可以验证C和F两种元素非金属性强弱的结论是(填编号) ;
① 比较这两种元素常见单质的熔点
② 比较这两种元素的单质与氢气化合的难易程度
③ 比较这两种元素的气态氢化物的还原性
(4) A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为 、 。
(5)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 。
在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
(1)x=__________(有过程)
(2)温度降低,K值增大,则正反应是_________(填“放热”或“吸热”)反应。
(3)B的转化率为_________(有过程)。
(4)能判断该反应达到平衡状态的依据是________(填编号)
| A.混合气体的密度不变 |
| B.容器中的压强不再变化 |
| C.生成D的反应速率是生成B的反应速率的2倍 |
| D.单位时间内生成3molA,同时生成1molB |
反应3Fe(S)+4H2O====Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率的变化是(填增大、不变、减小,以下相同)
(2)将容器的体积缩小一半,其正反应速率,逆反应速率。
(3)保持体积不变,充入N2使体系压强增大,其正反应速率,逆反应速率。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率逆反应速率。
可逆反应aA(g)+bB(g)  pC(g),反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示压强不同的曲线,B图表示的是温度不同的曲线,试比较下列大小关系:P1______ P2,T1______ T2,ΔH_____ 0,a+b______ p。
pC(g),反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示压强不同的曲线,B图表示的是温度不同的曲线,试比较下列大小关系:P1______ P2,T1______ T2,ΔH_____ 0,a+b______ p。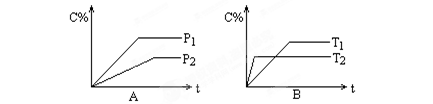
依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ__________
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X |
Y |
|
| Z |
W |
请回答下列问题:
(1)元素Z位于周期表中第______________周期,___________族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________;
(4)Y的最高价氧化物的化学式为________________;
(5)W和Y形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________。