下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
| 元素代号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
| 原子半径(nm) |
0.186 |
0.160 |
0.152 |
0.143 |
0.110 |
0.099 |
0.075 |
0.074 |
| 主要化合价 |
+1 |
+2 |
+1 |
+3 |
+5、-3 |
+7、-1 |
+5、-3 |
-2 |
回答下列问题:
(1)⑥在元素周期表中的位置是(周期、族) 。
(2)在这8种元素的最高价氧化物的水化物中,酸性最强的是 (填化学式)。
(3)①⑥形成物质的电子式
(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:
。
(5)下列叙述正确的是 (填字母)。
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性
立方烷是一种新合成的烃,其分子为正立方体结构,其碳架结构如图所示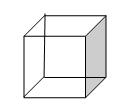
(1)写出立方烷的分子式________.
(2)其二氯代物共有_______种同分异构体。
请写出实现下列转变的各步反应的化学方程式,特别注意要写明反应条件。 (1)由CH3CH2CH2CH2Br分两步转变为CH3CH2CHBrCH3
(1)由CH3CH2CH2CH2Br分两步转变为CH3CH2CHBrCH3
(2)由(CH3)2CHCH=CH2分两步转变为(CH3)2CHCH2CH2OH
有机物的结构可用“键线式”简化表示。CH3—CH=CH-CH3可简写为  。
。
有机物X的键线式为: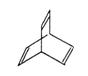
(1)有机物Y是X的同分异构体,
且属于芳香烃,写出 Y的结构简式。
Y的结构简式。
(2)Y与乙烯在一定条件下发生等物质的量聚合反应,写出其反应的化学方程式:
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有种 .
甲醇是一种可再生能源,具有广泛的开发和应用前景。在容积为2L的密闭容器中充入lmol CO与2molH2在催化剂作用下反应生成甲醇: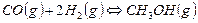 , CO
, CO
平衡转化率与温度、压强的关系如意图所示;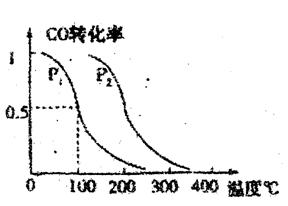
(1) Pl____P2(填大于、小于或等于)
(2) 若Pl为1标准大气压,反应温度为100℃,此条件下反应达到平衡:
①达到平衡所需的时间为5min,用H2表示的平均反应速率为________。
②反应的平衡常数K=。
③平衡时,测得其能量的变化量为akJ。则该反应的热化学方程式是:
。
(3) 恒容恒温情况下,再增加lmol CO与2molH2,达到新平衡时.CO的转化率.
(填“增大”、“减小”或“不变”),平衡常数____。(填“增大”、“减小”或“不变”)
(4) 为了寻找一定催化剂下合成甲醇的适宜温度条件,某同学设计了一组实验,该实验中应控制的不变量是。
Ⅰ. 现有①0.2mol/L NaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中 c(Na+)>c(X-):
(1) 混合液显性(填“酸”、“碱”或“中”),其原因用离子方程式表示
。
(2) 上述混合液中:(填“>”、“=电”或“<”)
c(Hx)c(X-); c(OH-)c(HX)+c(H+)
Ⅱ.下图是一个用铂丝作电极,电解稀的MgS04溶液的装置,电解液中滴有酚酞试剂,回答
下列问题;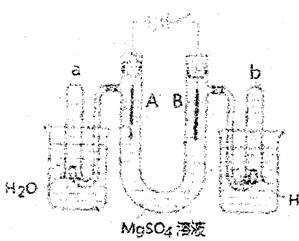
(1) 通电时,A管中的现象是。
(2) ①通电时,A管中发生的反应方程式:。
②通电时,B管中发生的反应方程式:。