有两个实验小组的同学为探究过氧化钠与二氧化硫反应,都用如图所示的装置进行实验。通过SO2气体,将带余烬的木条插入试管C中,木条复燃。
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:____________。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
上述方案是否合理?_______________________________________________。
请简要说明两点理由:①_____________________________;② __________________。
如图所示3套实验装置,分别回答下列问题:


(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被_______;向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为_______________。
(2)装置2中的石墨是_________极(填“正”或“负”),该装置发生的总反应的离子方程式为__________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
①电源的M端为_________极,甲烧杯中铁电极的电极反应为________________;
②乙烧杯中电解反应的离子方程式为______________;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,则甲烧杯中产生的气体在标准状况下为________ mL。
直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
(1)101KPa时,1mol气态CH3OH完全燃烧生成CO2气体和液态水时,放出726.51kJ的热量,则甲醇燃烧的热化学方程式是 .
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O (g)═CO2(g)+3H2(g);△H1═+49.0KJ•mol﹣1
②CH3OH(g)+ O2(g)═CO2(g)+2H2(g);△H2═?
O2(g)═CO2(g)+2H2(g);△H2═?
已知H2(g)+ O2(g)═H2O (g)△H═﹣241.8KJ•mol﹣1,则反应②的△H2= .
O2(g)═H2O (g)△H═﹣241.8KJ•mol﹣1,则反应②的△H2= .
(3)一种甲醇燃料电池是采用铂或碳化钨作电极,稀硫酸作电解液,一极直接加入纯化后的甲醇,同时向另一个电极通人空气.则甲醇进入 极,正极发生的电极反应方程式为 .
实验题:将V1 mL 1.0mol•L﹣1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始保持V1+V2=50mL).请按要求填空: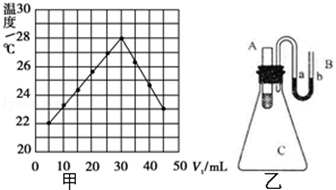
(1)该实验表明此反应 (填吸收、释放)能量,即: 能可以转化为 能,通过甲图示分析可以得出:做该实验时,环境温度 (填高于、低于、等于)22℃;
(2)根据甲图示计算该NaOH溶液的浓度约是 mol•L﹣1
(3)如图乙所示,在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:
①烧碱固体 ②浓硫酸 ③硝酸铵固体 ④NaCl固体
其中能使a端液面高于b端液面的是 .(填序号)
[化学选修——5:有机化学基础]立方烷( )具有高度的对称性.高致密性.高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
)具有高度的对称性.高致密性.高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
回答下列问题:
(1)C的结构简式为 ,E的结构简式为 。
(2)③的反应类型为 ,⑤的反应类型为
(3)化合物A可由环戊烷经三步反应合成:
反应1的试剂与条件为 ;反应2的化学方程式为 ;反应3可用的试剂为 。
(4)在I的合成路线中,互为同分异构体的化合物是 (填化合物代号)。
(5)I与碱石灰共热可转化为立方烷。立方烷的核磁共振氢谱中有 个峰。
(6)立方烷经硝化可得到六硝基立方烷,其可能的结构有 种。
[化学—选修3:物质结构与性质]早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: ,可用硫氰化钾检验三价铁离子,形成配合物的颜色为 。
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为 ,一摩尔乙醛分子中含有的σ键的数目为 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm(晶胞参数就是晶胞立方体的边长),晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)