在甲、乙两个容积均为1L的密闭容器中,保持两容器的温度相同,进行如下反应:2A(g)+B(g) pC(g),①向甲中通入3molA和1.5molB,达到平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和2molC,平衡时测得C的体积分数为M%。试回答:
pC(g),①向甲中通入3molA和1.5molB,达到平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和2molC,平衡时测得C的体积分数为M%。试回答:
⑴若M%=40%,且平衡时甲、乙压强不同,则乙平衡时c(B)=
⑵若M%=40%,且平衡建立前后乙中压强不同,则p= ,求此条件下反应达到平衡时的压强P2与开始反应时的压强P1之比,P2∶P1=
⑶若p=4,则M% 40%(填“大于”、“小于”或“等于”);平衡时甲、乙中 c (A)的浓度大小: (填“甲大”、“乙大”、“一样”)
(每空3分,共12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各题: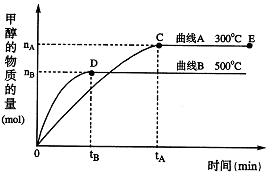
(1)在500℃,从反应开始到刚好达到平衡,氢气的平均反应速率ν(H2)=(用图中相应字母表示)
(2)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的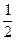 ,下列有关该体系的说法正确的是(填序号)
,下列有关该体系的说法正确的是(填序号)
a氢气的浓度减少b正反应速率加快,逆反应速率变慢,平衡正向移动
c甲醇的物质的量增加 d重新平衡时c(CO)/c(CH3OH)增大
(3)从反应的方向判断,正向进行的反应(填序号:
| A.高温时 | B.低温时 | C.任何温度都能 | D.任何温度都不能)自发进行。 |
(4)在不改变反应物用量的情况下,提高CO的转化率采取的措施是
(答两点即可)
(每空3分,共15分)原子序数依次增大 的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两
的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两 种氧化物。
种氧化物。 (1)W元素在元素周期表的位置为
(1)W元素在元素周期表的位置为 ,用电子式表示其气态氢
,用电子式表示其气态氢 化物。
化物。 (2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是
(2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是
。 (3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是
(3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是 。
。
(4)一定物质的量的稀硝酸恰能将Z的砖红色的氧化物氧化,自身被还原成NO。则反应中氧化剂与还原剂的物质的量的比为。
(每空3分,共12分)常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下: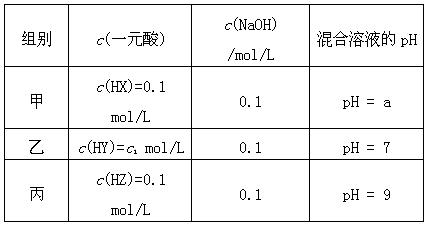
(1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”)。
(2)乙组实验中HY为强酸,则HY溶液的pH=。
(3)丙组实验发生反应的离子方程式为,
所得溶液中由水电离出的c(OH-) =mol/L。
(15分)
某有机物X(C12H13O6Br)遇到FeCl3溶液显紫色,其部分结构简式如下: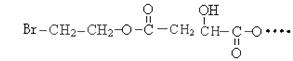
已知加热X与足理的NaOH水溶液反应时,得到A、B、C三种有机物,其中C中含
碳原子最多。室温下A经盐酸酸化可得到苹果酸E,E的结构简式为: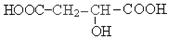
请回答:
(1) B中含有的官能团为。(填名称)
(2)1molX与足量的NaOH水溶液充分反应,消耗NaOH的物质的量为。
(3)C经酸化可得到有机物G,G不能发生的反应类型有(填序号)。
①加成反应②消去反应③氧化反应④取代反应
(4)1 molC酸化后与足量浓溴水充分反应需mol Br2 。
(5) E在浓H2SO4作用下可生成六元环状化合物,其化学方程式为。
(6)E的两种同分异构体F、G有如下特点:1molF或G可以和3molNa发生反应,放出标准状况下33.6LH2,1molF或G可以和足量NaHCO3溶液反应,生成1molCO2,1molF或G还可以发生银镜反应,生成2molAg。则F和G的结构简式分别是、。
(15分)
Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:
(1)下列说法正确的是__________(填序号)
| A.砷化镓晶胞结构与NaCl相同 | B.第一电离能 As>Ga |
| C.电负性 As>Ga | D.原子半径 As>Ga |
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为__________;
(3)AsH3空间形状为___________;已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ.金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因, Cu2+的核外电子排布式为__________________________。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有和。