下列叙述中正确的是 ( )
①标准状况下,1 L HCl和1 L H2O的物质的量相同;
②标准状况下,1 g H2和14 g N2的体积相同;
③28 g CO的体积为22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤在同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
| A.①②③ | B.②⑤⑥ |
| C.②③⑥ | D.④⑤⑥ |
25℃,向50 mL 0.018 mol/L AgNO3 溶液中加入50 mL 0.02 mol/L 盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10,则生成沉淀后的体系中c(Ag+)为(忽略溶液体积变化)
| A.1.8×10-7mol/L | B.1.8×10-8 mol/L |
| C.1.8×10-9mol/L | D.1.8×10-10mol/L |
在1LK2SO4和CuSO4的混合溶液中,c(SO42-)="2.0" mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中K+的物质的量浓度为
| A.2.0 mol·L-1 |
| B.1.5 mol·L-1 |
| C.1.0 mol·L-1 |
| D.0.5 mol·L-1 |
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol•L-1 NaHC2O4溶液中滴加0.01 mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)=0时,c(H+)=1×10-2 mol•L-1 |
| B.V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L |
| D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-) |
如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释合理的是
| A.生铁片中的碳是原电池的负极,发生还原反应 |
| B.雨水酸性较强,生铁片始终发生析氢腐蚀 |
| C.导管内墨水液面回升时,正极反应式为:O2+2H2O+4e—==4OH- |
| D.U型管中溶液pH逐渐减小 |
有关下列图像的说法正确的是
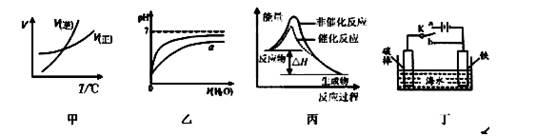
| A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0 |
| B.图乙表示向pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,则其中曲线a对应的是醋酸 |
| C.图丙表示该反应为放热反应.且催化剂能降低反应的活化能、改变反应物的焓 |
| D.图丁中开关K置于a或b处均可减缓铁的腐蚀 |