根据表中信息判断,下列选项不正确的是( )
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4… |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO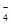 … … |
Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO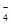 >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
下列叙述中不正确的是( )
| A.同周期元素中,ⅦA族元素的原子半径最小 |
| B.常温时,0族元素的单质都是气体 |
| C.ⅠA族金属元素的单质,其原子序数越大,熔点越低 |
| D.所有主族元素的原子,形成单原子离子时的化合价与它的族序数相等 |
X、Y、Z、R是1~18号元素中的四种元素,它们的原子结构有以下特点,其中金属性最强的是()
①元素X原子的M层比L层少3个电子②元素Y的2价阴离子的核外电子排布与氖原子相同③元素Z原子的L层比M层多5个电子④元素R原子的L层比K层多3个电子
| A.X | B.Y | C.Z | D.R |
根据政府气候变化专家的研究得知:①在过去的100年中,全球气温上升了0.56 ℃;②未来100年中全球气温可能会上升1.4—5.8 ℃。导致全球气温持续升高的主要原因是人类对于自然资源的不合理开发和利用(如矿石燃料的大量消耗;植被、森林、湿地的人为破坏;农业生产的不合理耕种方式),从而导致了大气中温室气体(如二氧化碳、甲烷等)的增加。根据上述内容完成下列问题:为减少因汽车燃料燃烧时所产生的二氧化碳气体排放,可大力开发下列哪种燃料汽车()
| A.氢氧燃料电池汽车 |
| B.太阳能汽车 |
| C.甲醇汽车 |
| D.天然气汽车 |
关于石油和煤说法中不正确的是()
| A.石油是液态烃,是纯净物,煤是组成复杂的混合物 |
| B.煤的气化和液化可制得清洁燃料,减少大气污染 |
| C.直馏汽油、裂化汽油、合成汽油均是石油产品 |
| D.用适当的方法使煤气化,可制得甲烷 |
科学家致力于二氧化碳的组合转化技术研究,把过多的二氧化碳转化为有益于人类的物质,如将CO2和H2O以1∶4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源。请完成以下化学方程式:CO2+4H2 ()+2H2O
()+2H2O
若将二氧化碳与氢气混合,在一定条件下以1∶3的比例发生反应,生成某种重要的化工原料和水,该化工原料可能是()
| A.烷烃 | B.烯烃 | C.炔烃 | D.芳香烃 |