在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
| A.该反应的△H>0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
C.300℃时,0-t1min内 CH3OH的平均生成速率为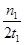 mol·L-1 min-1 mol·L-1 min-1 |
| D.A点的反应体系从300℃升高到500℃,达到平 |
衡时 减小
减小
某同学为了使反应2HCl+2Ag=2AgCl↓+H2↑能进行,设计了如下图所示四个实验,你认为可行的是 ( )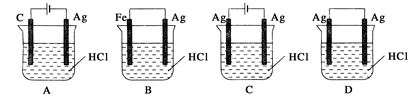
已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理一项是()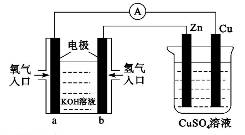
| A.该装置中Cu极为正极 |
| B.当铜极的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L |
C.b极反应的电极反应式为:H2一2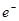 = 2H+ = 2H+ |
| D.一段时间后锌片质量减少 |
向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示。下列判断正确的是( )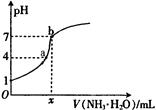
| A.x=20 |
| B.稀H2SO4的浓度为0.10mol/L |
| C.b点有:2c(NH4+) = c(SO42-)> c(H+) = c(OH-) |
| D.a点有:c(NH4+) < 2c(SO42-) |
对下列图像的描述正确的是()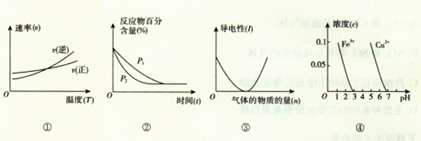
A.根据图①可判断反应A2(g)+3B2(g) 2AB3(g)的△H>0 2AB3(g)的△H>0 |
B.图②可表示压强(P)对反应2A(g)+2B(g) 3C(g)+D(s)的影响 3C(g)+D(s)的影响 |
| C.图③可表示向醋酸溶液通人氨气时,溶液导电性随氨气量的变化 |
| D.根据图④,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5 |
下列有关热化学方程式的叙述正确的是 ( )
| A.已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为-285.8 kJ/mol |
| B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol |
| D.已知2C(s)+2O2(g)===2CO2(g) ΔH1;2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2 |