火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)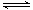 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,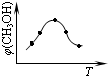
则上述CO2转化为甲醇的反应的△H3__________0(填“>”、“<”或“=”)。
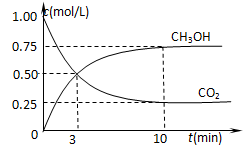
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。试回答:0~10 min内,氢气的平均反应速率为 mol/(L·min);该温度下,反应的平衡常数的值为 ;第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数 (填变大、减少、不变)。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。硫酸铵和硝酸铵的水溶液的pH<7,其原因用离子方程式表示为 ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+) + c(H+)__________c(NO3-) + c(OH-)(填写 “>”“=”或“<”)
取100mL的Na2CO3和Na2SO4混合溶液,加入100 mL Ba(OH)2溶液,恰好完全反应,过滤得到白色沉淀和滤液,沉淀干燥后质量为14.51g。用过量稀盐酸处理上述沉淀,沉淀质量减少到4.66g,并有气体放出。计算:
⑴ 原混合液中Na2SO4的物质的量浓度为mol ·L-1;
⑵ 过滤出沉淀后,所得滤液的物质的量浓度为mol ·L-1(设反应前后溶液的密度均为1g·cm-3,且反应前后溶液体积变化忽略不计);
⑶在处理沉淀时产生的气体在标准状况下的体积为L。
下图所涉及的物质均为中学化学中的常见物质,其中:①C、D、E、F都为单质,其余为化合物;②C、D、E 在常温下为气体,其它物质为固体或液体;③A、I 两种化合物的焰色反应分别为紫色和黄色;④反应①、②中的一些生成物已经略去,有些反应的条件未列出,它们存在如下转化关系。
⑴ 写出有关物质的化学式:
A,D,F,I。
⑵ 指出MnO2在相关反应中的作用:反应①中是剂,反应②中是剂。
⑶ 写出B与MnO2共热获得D的化学方程式____________________________________。
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
⑴ 海水中含有大量的氯化钠。请写出氯离子结构示意图。
⑵ 目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是(填物理变化、化学变化)。
⑶ 工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的化学方程式为。
⑷ 近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下: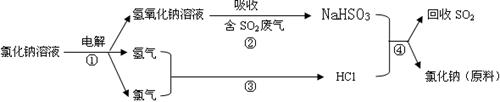
已知SO2和CO2都属于酸性氧化物,试写出②④的化学反应方程式:
②__________________________________;④_____________________________________。
(1)相同质量的臭氧(O3)和氧气(O2)所含的分子数之比是__________,所含原子数目之比是__________,在标准状况下所占的气体体积比是____________。
(2)在2KMnO4 + 16HCl="2KCl" +2MnCl2 + 5Cl2↑+ 8H2O反应中,若被氧化的HCl是0.4mol,则反应生成_________克氯气,转移的电子数是_______________个。
(3)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式并用双线桥标出电子转移情况。
②漂白粉的有效成分是(填化学式)。
某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:
⑴当m=1时,测定0.1mol/L HA的pH值,若0.1mol/L HA的pH>1,说明HA为酸(填“强”、 “弱”)。
测定0.1mol/L HA的值时,pH试纸预先用蒸馏水湿润(填“能”、“不能”)。
⑵取少量NamA固体溶于蒸馏水,再向得到的溶液中滴加2滴石蕊,若溶液由无色变成蓝色,证明HmA是酸(填“强”、 “弱”)。
若某浓度的NamA溶液pH=9,则该溶液中,水电离的C(H+)= mol/L
⑶室温下,将pH=2的酸HmA和pH=12的B(OH)n等体积混合,测得混合液的pH=8。
①写出生成正盐的化学方程式
②若该盐中只有一种能水解的离子,则HmA为酸(填“强”、 “弱”), 离子水解的方程式为
⑷现有某浓度的HmA溶液,蒸馏水,常见指示剂(如:石蕊、酚酞),pH试纸以及常用实验仪器,请你设计一种简单可行的实验方案,证明HmA是强酸还是弱酸。简述实验过程、现象、结论:
。