(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1) +  + + +H2O
+ + +H2O
(2)反应物中发生氧化反应的物质 ,被还原的元素是 。
(3)反应中1 mol氧化剂得到 mol电子。
如图表示某温度时,反应N2O4(g) 2NO2(g)在前110 s内的反应进行情况,请根据图像回答下列问题。
2NO2(g)在前110 s内的反应进行情况,请根据图像回答下列问题。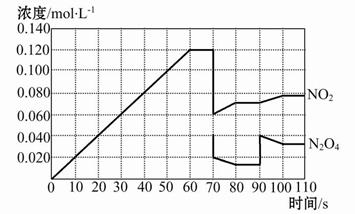
(1)该可逆反应达到平衡的时间段为。
(2)反应进行到70 s时,改变的条件可能是(填字母,下同),反应进行到90 s时,改变的条件可能是。
| A.加入催化剂 | B.扩大容器体积 |
| C.升高温度 | D.增大N2O4的浓度 |
(3)90 s后若维持容器的体积不变,平衡移动的方向为(填“正反应”、“逆反应”或“不移动”),此时N2O4的转化率(填“增大”、“减小”或“不变”)。
(4)请在图中画出反应物N2O4在0~70秒时的浓度变化曲线。
Ⅰ、一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)ΔH>0。
FeO(s)+CO(g)ΔH>0。
(1)下列措施中能使平衡时c(CO)/c(CO2)增大的是(填序号)。
A.升高温度B.增大压强
C.充入一定量氮气 D.再加入一些铁粉
(2)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,使CO2的浓度成为原来的2倍,则CO2的转化率将(填“增大”、“减小”或“不变”)。
Ⅱ、在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)  CO(g)+H2(g),试分析和回答下列问题:
CO(g)+H2(g),试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是(选填序号)。
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
(2)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小容积、其他条件不变),则容器内气体的平均相对分子质量将(填写“不变”、“变小”或“变大”)。
在5 L密闭容器中加入2 mol Fe(s)与1 mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35 mol。
(1)t1~t2这段时间内的化学反应速率v(H2)=。
(2)若继续加入2 mol Fe(s),则平衡移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1 mol H2O(g)再次达到平衡后,H2物质的量为 __________mol。
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件是 _________。
某恒容容器内发生的可逆反应的化学平衡常数表达式为: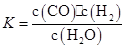 。能判断该反应一定达到化学平衡状态的依据是( )
。能判断该反应一定达到化学平衡状态的依据是( )
①容器中气体的平均相对分子质量不随时间而变化
②v正(H2O)=v逆(H2)
③容器中气体的密度不随时间而变化
④容器中气体总质量不随时间而变化
⑤消耗n mol H2的同时消耗n mol CO
| A.①②③ | B.①②③④ | C.② | D.①④⑤ |
溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。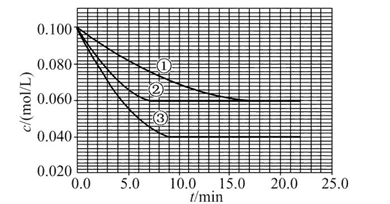
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:②;③。
(2)实验②平衡时B的转化率为;实验③平衡时C的浓度为。
(3)该反应的ΔH0,其判断理由是。
(4)该反应进行到4.0 min时的平均反应速率:实验②:v(B)=。