某澄清溶液,可能含有NH4+、Mg2+、Al3+、Na+、Cu2+、OH-、Cl-、I-、NO3-和SO42-等离子中的几种,现进行如下实验:
①在试管中取少许溶液,滴加几滴石蕊试液,溶液呈红色。
②另取原溶液少许,加入足量CCl4,在不断振荡的条件下加入足量氯水,静置,上层接近无色,下层呈紫红色。
③向②所得水溶液中加入AgNO3溶液,有白色沉淀生成。
④另取原溶液,滴加NaOH溶液,得白色沉淀;继续加入NaOH溶液至过量,沉淀部分溶解,过滤后给滤液加热,有刺激性气味的气体产生。
(1)由此判断原溶液中一定有大量的 离子。
(2)步骤②反应的离子方程式是________________________________
(3)步骤④中沉淀溶解的离子方程式是
(4)还不能确定的阳离子是 ,如何检验?(写出实验名称及判断依据的现象)
____________________________________________________________________.
(10分)
(1)常温下,0.1 mol/L的甲酸和0.1 mol/L的盐酸各100 mL,分别与足量的同浓度氢氧化钾溶液反应所需氢氧化钾溶液的体积前者__________后者(选填“>”、“<”或“=”)。
(2)常温下,0.1 mol/L的甲酸和pH=1的甲酸各100 mL,分别与足量的碳酸氢钠溶液反应,产生的气体前者比后者__________(选填“多”、“少”或“=”)。
(3)在25 ℃条件下,将pH=10的偏铝酸钠溶液稀释100倍,稀释后溶液的pH为(填选项字母,下同)__ ___。
A.10B.8 C.10~12之间 D.8~10之间
(4) 25 ℃时,向0.1 mol/L的甲酸溶液中加入少量甲酸钠晶体,当晶体溶解后测得溶液pH将____。
A.增大B.减小 C.不变 D.无法确定
(5) 室温下,向0.1 mol/L的H2SO4中加入足量的锌粒,若想减慢H2产生的速率,但又不影响H2的体积,可以向硫酸溶液中加入__________试剂。
A.硫化钠晶体 B.甲酸钠晶体 C.少量银粉 D.硫酸钠溶液
(12分)
25℃时,三种酸的电离常数为:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数K |
1.8×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |
请回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:________(填编号)
(2)常温下0.1 mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=________,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)D.c(OH-)/c(H+)
(3) 体积为10 mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000 mL,稀释过程pH变化如图;则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”)。
(4) 25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=_______mol/L(填准确数值)。
(4分)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol ·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++H2Y2-===CuY2-+2H+
(1)写出计算CuSO4·5H2O质量分数的表达式w=_______________;
(2)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是________。
A.未干燥锥形瓶 B.滴定终点时滴定管尖嘴中产生气泡
C.未除净可与EDTA反应的干扰离子
(10分)A~F六种元素中,除A外均为短周期元素,它们的原子结构或性质如下表所示:
| 元素 |
原子结构或性质 |
| A |
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| B |
二价阳离子与Ne原子具有相同的电子层结构 |
| C |
形成化合物种类最多的元素,其单质为固体 |
| D |
地壳中含量最多的元素 |
| E |
与D同主族 |
| F |
与E同周期,且最外层电子数等于电子层数 |
(1)A的某种氯化物的浓溶液可用于制作印刷电路铜板,反应的离子方程式为:________________。
(2)CD2分子中化学键的类型是_______________;其与上述某元素形成的物质发生置换反应的化学方程式是______________________。
(3)F的最高价氧化物对应的水化物与E的最高价氧化物对应的水化物反应的离子方程式为_______。
(4)由B、D两种元素形成的化合物的电子式为。
(8分)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)  2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)如图中表示NO2变化曲线的是 。用O2表示从0 s~2 内该反应的平均速率v= mol/(L·s)。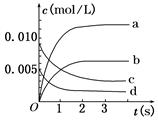
(2)能说明该反应已达到平衡状态的是 .
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂