下表中元素均为中学化学常见短周期元素根据表中信息,下列说法不正确的是
| 元素代号 |
X |
Y |
Z |
W |
N |
| 原子半径/nm |
0.186 |
0.074 |
0.102 |
0.099 |
0.16 |
| 主要化合价 |
+1 |
-2 |
-2+6 |
+7-1 |
+2 |
A.X和W形成的化合物是共价化合物
B.常温下单质与水反应速率X大于N
C.最高价氧化物对应水化物酸性W大于Z
D.X和Y的单质在一定条件下反应可生成一种淡黄色的固体化合物
某有机物的结构为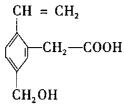 ,这种有机物不可能具有的性质是()
,这种有机物不可能具有的性质是()
| A.能使酸性KMnO4溶液褪色 | B.能发生酯化反应 |
| C.能发生水解反应 | D.能跟NaOH溶液反应 |
在允许加热的条件下,只用一种试剂就可以鉴别氯化钠、氯化镁、硫酸铵、硫酸铝和硫酸铁溶液,这种试剂是()
| A.AgNO3 | B.BaCl2 | C.NaOH | D.NH3·H2O |
能正确表示下列化学反应的离子方程式的 是()
是()
| A.金属钾投入水中K+H2O=K++OH-+H2↑ |
| B.氢氧化铝与盐酸反应:OH-+H+=H2O |
| C.用食醋除水垢CaCO3+2H+=Ca2++CO2↑+H2O |
D.电解饱和食盐水2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
右图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中不正确的是()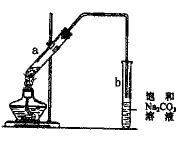
| A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加乙酸 |
| B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 |
| C.制得的乙酸乙酯是一种无色透明、有香味的油状液体 |
| D.向a试管中加入几块碎瓷片的作用是防止加热时液体暴沸 |
短周期元素X 、Y、Z在周期表中的位置如图所示,则下列说法正确的是()
、Y、Z在周期表中的位置如图所示,则下列说法正确的是()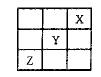
| A.Z一定是活泼的金属 |
| B.Y元素与第IA族的元素只能形成离子化合物 |
| C.X、Y、Z三种元素中X元素的得电子能力最强 |
| D.Z的最高价氧化物的水化物是强酸 |