下列物质中,能够导电的电解质是()
| A.Cu丝 | B.熔融的NaOH | C.NaCl溶液 | D.熔融的蔗糖 |
下列实验操作或事故处理中,做法不正确的是()
| A.不慎将酸溅到眼中,立即用水冲洗,边洗边眨眼睛 |
| B.不慎将浓碱溶液沾到皮肤上,立即用大量水冲洗,然后涂上硼酸溶液 |
| C.不慎碰翻实验桌上燃着的酒精灯失火,马上用湿布扑灭 |
| D.配制硫酸溶液时,先在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸 |
一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);△H<0。现将1mol A和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H<0。现将1mol A和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是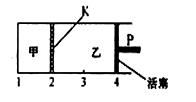
| A.保持温度和活塞位置不变,在甲中再加入1molA和2molB,达到新的平衡后,甲中C的浓度与乙中C的浓度相等 |
| B.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数与甲中C的体积分数相等 |
| C.保持温度不变,向甲中加入氦气后,甲中各物质的浓度改变 |
| D.保持温度和乙中压强不变,向乙中加入氦气后,乙中平衡正向移动 |
某学习小组拟利用如下装置制备氮化钙(化学式:Ca3N2,极易与H2O反应)
下列说法正确的是
| A.打开活塞K通入N2,试管A内有气泡产生,说明装置气密性良好 |
| B.U形管中盛放的干燥剂既可以用碱石灰,也可以用浓硫酸 |
| C.反应结束后,先熄灭酒精灯,待反应管冷却后再关闭活塞K |
| D.将产物Ca3N2放入盐酸中,只能得到一种盐 |
一定量的锌与密度为1.85g/cm3,质量分数为98%,体积50mL 的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体16.8 L。将反应后的溶液稀释至0.5 L,测得溶液中c(H+)=0.1mol·L-1。则生成的气体中H2和SO2的体积比为
|
| A.4:1 | B.1:2 | C.1:4 | D.3:1 |