NA表示阿伏加德罗常数的值,下列说法正确的有几个:
①在常温常压下,1mol氦气含有原子数为2NA
②0.5molO2和0.5molO3的混合物所含有的氧原子个数为2.5NA
③常温常压下,18 g H2O中含有的原子总数为3NA
④常温常压下,2.24 LCO和CO2混合气体中含有的碳原子数目为0.1NA
⑤含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol·L-1
⑥1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
⑦1 mol·L-1 NaCl溶液含有NA个Na+
⑧常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
⑨13.5g Al与足量盐酸反应生成H2的分子数为NA
⑩标准状况下,2.24LCH4所含电子数为NA
| A.3 | B.4 | C.5 | D.6 |
下列操作能使H2O的电离平衡向逆方向移动,且溶液呈碱性的是
| A.向水中加NaHCO3 | B.向水中加NaHSO4 |
| C.向水中加FeCl3 | D.向水中加CaO |
一定温度下,反应2 SO2 + O2 2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)="0.8mol," n(SO3)=1.4mol,此时SO2的物质的量应是
2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)="0.8mol," n(SO3)=1.4mol,此时SO2的物质的量应是
| A.0.4mol | B.0.6mol | C.0.8mol | D.1.2mol |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g) 2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是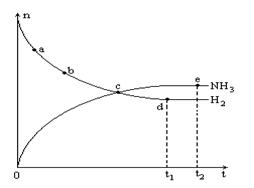
| A.点a的逆反应速率比点b的大 |
| B.点c处反应达到平衡 |
| C.点d (t1时刻)和点e (t2时刻)处n(N2)不一样 |
| D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大 |
对达到平衡状态的可逆反应:X+Y  W+Z,在t'时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是
W+Z,在t'时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是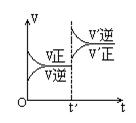
| A.X、Y、W为气体,Z不是气体 |
| B.X、Y为气体,W、Z中有一种是气体 |
| C.W、Z为气体,X、Y中有一种是气体 |
| D.W、Z中有一种为气体,X、Y都不是气体 |
下列各组物质的颜色变化,可用勒夏特列原理解释的是
| A.新制的氯水在光照条件下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.KI溶液加氯水振荡后颜色变深 |
| D.加入催化剂有利于氨氧化的反应 |