在20g密度为dg/cm3的硝酸钙溶液里含1g Ca2+,则NO3-离子的物质的量浓度是( )
A. mol·L-1 mol·L-1 |
B.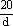 mol·L-1 mol·L-1 |
C.2.5d mol·L-1 | D.1.25 d mol·L-1 |
实验报告中,以下数据合理的是
| A.用碱式滴定管量取25.03mLH2SO4溶液 |
| B.用50mL量筒量取21.48mL稀硫酸 |
| C.用托盘天平称取11.7gNaCl |
| D.用pH试纸测定HNO3溶液的pH=3.7 |
下列事实一定能证明HNO2是弱电解质的是
①常温下 NaNO:溶液的pH大于7
②HNO2不稳定,受热易分解
③HNO2和NaCl不能发生反应
④常温下0.1 mol·L一1HNO2溶液的pH=2.1
⑤常温下pH=3的HNO2溶液和pH=11的NaOH溶液等体积混合,pH小于7
⑥常温下pH=2的HNO2溶液稀释至100倍,pH约为3.1
| A.①④⑥ | B.①②④⑤⑥ | C.①④⑤⑥ | D.全部 |
下列说法正确的是
| A.反应CaCO3(s)=CaO(s)+CO2(g),在常温下不能自发进行,则该反应的△H<0 |
B.0.lmol·L一1CH3COOH溶液加水稀释后,溶液中 的值减小 的值减小 |
| C.铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| D.锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
常温下有以下体积相同的四种溶液:①pH=3的CH3COOH溶液②pH=3的盐酸③pH=11的氨水④pH=11的NaOH溶液。下列说法正确的是
| A.②和③混合,所得混合溶液的pH大于7 |
| B.③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③=④ |
| C.①与②分别与足量镁粉反应,生成H2的量:①<② |
| D.若将四种溶液稀释100倍,溶液pH大小顺序:③>④>①>② |
短周期元素A、B、C、D、E原子序数依次增大,其中A、C同主族,B、E同主族,A的最外层电子数与次外层电子数相等,E是太阳能转化为电能的常用材料,则下列说法正确的是
A.最高价氧化物对应水化物碱性强弱:A>C
B.C、D的简单阳离子均可促进水的电离
C.B、E的最高价氧化物具有相似的物理性质和化学性质
D.含D的盐溶于水一定显酸性