在 2KMnO4+16HCl═2MnCl2+2KCl+5Cl2↑+8H2O反应中.
(1)______元素被氧化,氧化产物是______; 还原产物是______;氧化剂和还原剂的物质的量之比为___________.
(2)用双线桥法表示该反应的电子转移情况.
下图为长式周期表示意图,请根据A~G元素所在位置回答下列问题。
| A |
|||||||||||||||||
| B |
C |
D |
|||||||||||||||
| E |
F |
||||||||||||||||
| G |
|||||||||||||||||
注:答题时需将代号A~G替换为相应的元素符号
(1)元素A与C可形成两种分子C2A4与CA3,写出C2A4的结构式_______________。
(2)元素E与D能形成两种化合物E2D2与E2D,写出E2D2的电子式______________。
(3)元素A~G中,属于过渡元素的是_________。
(4)元素B、F的非金属性强弱关系为___________,设计实验验证此结论__________
________________________________________________________________________。
在标准状况下,18 g CO和CO2的混合气体完全燃烧后得到11.2 L CO2。则原混合气体的密度是_______________;原混合气体中,CO的质量是______________g,CO2的体积是______________,碳原子和氧原子的个数比为______________。
许多物质的氧化能力受溶液酸碱性的影响。高锰酸钾在不同条件下发生的还原反应如下:
①酸性:MnO4-+5e-+8H+→Mn2++4H2O;
②中性:MnO4-+3e-+2H2O→MnO2+4OH-
③碱性:MnO4-+e-→MnO42-(溶液呈绿色)
MnO2的还原反应可表示如下:MnO2+4H++2e-→Mn2++2H2O
(1)MnO2与稀盐酸不能制取氯气,其原因是___________________________________。
(2)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列叙述正确的是_______。(选填编号)
a.氧化性:PbO2>KMnO4 b.还原性:PbO2>KMnO4 c.该反应可以用盐酸酸化
(3)写出将SO2通入KMnO4溶液中所发生反应的离子方程式,并配平:
________________________________________________________________________。
(4)将高锰酸钾溶液逐滴加入到硫化钾溶液中可发生如下反应,已知产物中K2SO4和S的物质的量之比为3∶2。完成并配平该反应的化学方程式:
□KMnO4+□K2S+□__________→□K2MnO4+□K2SO4+□S↓+□__________,反应若生成5.44 g硫单质,反应过程中转移电子的物质的量为__________________。
铜(Cu)是重要金属,铜的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)向CuSO4浓溶液中滴入浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液。再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4•H2O晶体。
①沉淀溶解的离子方程式为_______________________________________________。
②乙醇的作用是_________________________________________________________。
③[Cu(NH3)4]2+具有对称的立体构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的立体构型为____________________,其中N原子的杂化轨道类型是________。
(2)金(Au)与铜为同族元素,铜与金可形成具有储氢功能的合金。
①合金中,原子间的作用力是_______________。已知Au为第六周期元素,则基态Au原子的价电子排布式为________,Au的原子序数为________。
②该储氢合金为立方最密堆积结构,晶胞中Cu原子位于面心、Au原子位于顶点,储氢时,H原子进入由Cu原子与Au原子构成的四面体空隙中,则该晶体储氢后的化学式为_______________。
水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)在酸性溶液中,水分子容易得到一个H+,形成水合氢离子(H3O+)。对于这一过程,下列描述不合理的是______________。
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
根据价层电子对互斥理论推测H3O+的形状为_____________________。
(2)水分子和硫化氢分子的键角及中心原子的杂化方式如下表:
| 分子 |
H2O |
H2S |
| 中心原子杂化方式 |
sp3 |
|
| 键角 |
104.5° |
92.1° |
| 键长 |
95.7 pm |
133.6 pm |
根据表格中的数据判断O-H键键能______(填“>”、“=”或“<”)S-H键键能。用电负性知识解释H2O的键角大于H2S的键角的原因:________________________
__________________________________________________________。
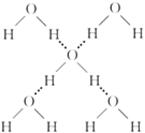
(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是________kJ/mol。