[化学——物质结构与性质]
物质结构理论有助于人们研究化学反应规律。请回答下列问题:
(1)在第三周期中,第一电离能大于硫的元素有 种;
(2)铜及其化合物在科学研究和工农业生产中有许多用途。
①铜原子价电子排布式为
②氯、钾、铜(+1价)三元素可形成一种化合物,该化合物阴离子为无限长链结构(如图甲),a位置上Cl原子的杂化轨道类型为 。该化合物阴离子的化学式为 ;
③向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是 。
| A.氨气极易溶液水,是因为NH3分子和H2O分子之间形成3种不同的氢键 |
| B.NH3分子的键角小于H2O分子的键角 |
| C.[Cu(NH3)4]SO4所含的化学键有离子键、极性共价键和配位键 |
| D.[Cu(NH3)4]SO4组成元素中电负性最大的是氮元素 |
④葡萄糖与新制氢氧化铜的碱性溶液反应生成砖红色沉淀A,其晶胞如右图乙所示。A的化学式为 ,晶胞中的白点代表的原子是 (填元素名称)。
(9分)A、B、C、D、E为原子序数依次增大的短周期元素。已知A、B、E三原子最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水;C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。请回答下列问题:
(1)写出下列元素符号:A________,C________,E________。
(2) E元素+1价含氧酸的电子式为:_________________。
(3)写出A、B两元素最高价氧化物对应的水化物相互反应的离子方程式______________。
(4)比较C、D最高价氧化物对应水化物的酸性__________________。
(6分)请观察下列化合物A~H的转换反应的关系图(图中副产物均未写出),请填写:
(1)写出反应类型:
反应①_____________________________;反应⑦_____________________________。
(2)写出结构简式:
B_____________________________;H_____________________________。
(3)写出反应⑥的化学方程式:_____________________________。
常温下,将某可溶性一元碱XOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
XOH物质的量浓度(mol·L-1) |
HCl物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH<7 |
| 丁 |
0.1 |
0.1 |
pH=5 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明XOH是强碱还是弱碱_________________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________(选填“是”或“否”)。混合液中离子浓度c(Cl-)与 c(X+)的大小关系是________________________。
(3)丙组实验结果分析,XOH是________碱(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Cl-)-c(X+)=________mol·L-1 c(H+)-c(XOH)=________mol·L-1
利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第三周期,两种元素原子的质子数之和为27,则R的原子结构示意图为________。
②常温下,不能与M单质发生反应的是________(填序号)。
| A.CuSO4溶液 | B.Fe2O3 | C.浓硫酸 | D.NaOH溶液 |
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法
已知:H2S(g)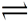 H2(g)+
H2(g)+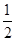 S2(g)
S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见下图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985℃时H2S按上述反应分解的平衡常数K=________;说明随温度的升高,曲线b向曲线a逼近的原因:____________________________________。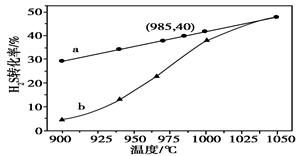
②电化学法
该法制氢过程的示意图如下。反应池中反应物的流向采用气、液逆流方式,其目的是____________________;反应池中发生反应的化学方程式为____________________。反应后的溶液进入电解池,电解总反应的离子方程式为_______________。
(8分)某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)肯定不存在的离子是___________________________。
(2)写出步骤②中生成沉淀和气体的反应的离子方程式____________________;
(3)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?______(填“有”或“无”)。