【化学——选修3 物质结构基础】
氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为 ,氧元素与氟元素能形成OF2分子,该分子的空间构型为 。
(2)根据等电子原理,判断NO2+离子中,氮原子轨道的杂化类型为 ,1mol NO2+所含 键的数目为 。
键的数目为 。
(3)氧元素与过渡元素可以形成多种价态的金属氧化物。如铬可生成Cr2O3、CrO3等,试写出Cr3+核外电子排式 。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由 此可判 断该钙的氧化物的化学式为 。
已知晶胞边长为540pm,则该氧化物的密度是 g·cm-3
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:。
(2)“灼烧”时发生反应的化学方程式:。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:。
(4)副产品X的化学式是:;可循环利用的物质是:_____________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为。
(6)检验产品中含有碳酸钠杂质所需试剂是(填编号)
①酸性高锰酸钾②品红溶液③澄清石灰水④饱和碳酸氢钠溶液⑤NaOH⑥稀硫酸
CO2和CO是工业排放的对环境产生影响的废气。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为。
(2)科学家们提出用工业废气中的CO2制取甲醇:CO2+3H2CH3OH+H2O。制得的CH3OH可用作燃料电池的燃料。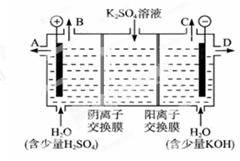
①在KOH介质中,负极的电极反应式为_________________________________。
②作介质的KOH可以用电解K2SO4溶液的方法制得。则KOH在_______出口得到,阳极的电极反应式是:_____________________________________。
(3)利用CO与H2反应可合成CH3OCH3。
已知:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
在一定条件下的密闭容器中,该反应达到平衡,要提高CO的转化率,可以采取的措施是.
| A.低温高压; | B.加入催化剂; | C.体积不变充入氦气; | D.增加CO的浓度;E.分离出二甲醚 |
(4)CH3OCH3也可由CH3OH合成。已知反应2CH3OH(g)  CH3OCH3(g) + H2O(g),在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
CH3OCH3(g) + H2O(g),在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.01 |
0.2 |
0.2 |
①0-10 min内反应速率v(CH3OH) = 。
②该温度下的平衡常数为。
③若平衡后,再向容器中再加入0.01mol CH3OH和0.2mol CH3OCH3,此时正、逆反应速率的大小:
v正v逆 (填“>”、“<”或“=”)。
莫沙朵林是一种镇痛药,它的合成路线如下:
(1)化合物D中含氧官能团的名称为。
(2)下列说法正确的是_________
| A.1 mol B可以与4 mol CH3COOH发生酯化反应 |
| B.C的分子式为C5H4O2 |
| C.D→E的反应是加成反应 |
| D.E可以发生消去反应,F可与HCl反应 |
(3)C与新制氢氧化铜反应的化学方程式为。
(4)写出同时满足下列条件的E的一种同分异构体的结构简式:。
I.核磁共振氢谱有4个峰; Ⅱ.能发生银镜反应和水解反应; Ⅲ.能与FeCl3溶液发生显色反应。
(5)已知E+X→F为加成反应,化合物X的结构简式为。
(6)已知: 。化合物
。化合物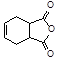 是合成抗病毒药阿昔洛韦的中间体,它可以用
是合成抗病毒药阿昔洛韦的中间体,它可以用 经氧化、消去、成酐一系列反应后再和原料M合成。
经氧化、消去、成酐一系列反应后再和原料M合成。
①则M的结构简式为
②其中的消去反应的化学方程为:
硫酸亚锡(SnSO4)可用于镀锡工业.某小组设计SnSO4制备路线为:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡
(1)锡原子的核电荷数为50,与碳元素同处ⅣA族,锡位于周期表的第周期
(2)操作Ⅰ是 过滤、洗涤等
(3)溶解SnCl2粉末需加浓盐酸,原因是
(4)加入Sn粉的作用有两个:①调节溶液pH②
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是
(6)酸性条件下,SnSO4与双氧水去反应的离子方程式是
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定②生成的Fe2+,再计算锡粉的纯度,请配平方程式:
FeCl2 +K2Cr2O7 +HCl = FeCl3 + KCl + CrCl2+
100℃时,在1L恒温恒容的密闭容器中,通入0.1 mol N2O4,发生反应:N2O4(g)  2NO2(g);△H=" +57.0" kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
2NO2(g);△H=" +57.0" kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
(1)在0~60s内,以N2O4表示的平均反应速率为 mol·L-1·s-1。
(2)根据甲图中有关数据,计算100℃时该反应的平衡常数K1==0.36mol.L-1.S-1
若其他条件不变,升高温度至120℃,达到新平衡的常数是k2,则k1k2(填“>”、“<”或“=”)。(3)反应进行到100s时,若有一项条件发生变化,变化的条件可能是。
A.降低温度 B.通入氦气使其压强增大 C.又往容器中充入N2O4 D.增加容器体积
(4)乙图中, 交点A表示该反应的所处的状态为。
A.平衡状态 B.朝正反应方向移动C.朝逆反应方向移动D.无法判断
(5)已知N2(g)+2O2(g)=2NO2(g)△H=" +67.2" kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=" -534.7" kJ·mol-1
N2O4(g)  2NO2(g)△H=" +57.0" kJ·mol-1
2NO2(g)△H=" +57.0" kJ·mol-1
则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=kJ·mol-1