设水的电离平衡线如图3-4所示:(1)若以A点表示20 ℃时水在电离平衡时的离子浓度,当温度上升到100 ℃时,水的电离平衡状态到B点。则此时水的离子积______从增大到______。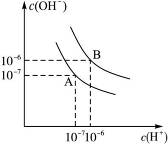
图3-4
(2)将100 ℃时pH=8的Ba(OH)2溶液与pH=5的稀H2SO4混合,并保持100 ℃的恒温。欲使混合液的pH=7,则Ba(OH)2与稀H2SO4的体积比为(二者混合后体积假设为二者体积之和)。
烷基取代苯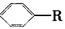 可以被KMnO4酸性溶液氧化生成
可以被KMnO4酸性溶液氧化生成 ,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被
,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被 氧化得到
氧化得到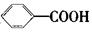 。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为
。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为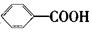 的同分异构体共有7种,其中的3种是:
的同分异构体共有7种,其中的3种是:
请写出其他的4种结构简式、、
、。
高分子化合物和我们人类的生活密切相关。
(1)请写出下列高分子化合物的单体。
①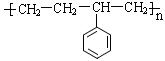 _________________________
_________________________
② ________________________
________________________
(2)腈纶(人造羊毛)的主要成份是聚丙烯腈(丙烯腈:CH2=CH—CN),由乙炔和氢氰酸(HCN)生产聚丙烯腈所涉及的有机化学反应方程式为:__________ ___________、_________。
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下: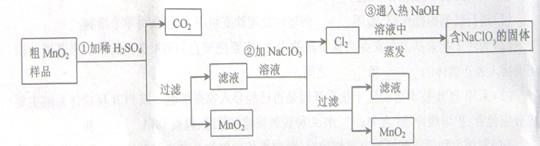
(1)第①步加稀H2SO4时,粗MnO2样品中的(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式(要配平)
+ClO3-+ =MnO2 + Cl2↑+ 。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、、、,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有(写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要mol NaClO3
已知X、Y、Z、W四种元素分别是元素周期表中三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________、Z__________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的结构式为:,它的共价键属于(填:极性、非极性)键;含有离子键和非极性共价键的化合物的电子式为。
(3)由X、Y、Z所形成的常见离子化合物是___________,该化合物与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式为:___________________;
X与W形成的化合物与水反应时,水是(填:氧化剂、还原剂)。
(8分)已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75%,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为常见的无色液体。反应生成的水均已略去。它们有如下图所示的关系。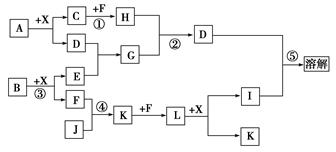
(1)写出化学式:A________,B________,J________。
(2)反应③中每生成1 mol F,转移电子的数目为______________。
(3)反应④的化学方程式为:______________________________。
(4)写出离子方程式:
反应②_______________________________________________;
反应⑤________________________________________________。
(5)反应①中,每1.00 g C与足量的F作用,恢复到25 ℃放出55.6 kJ热量,写出
反应①的热化学方程式。