有一包白色固体粉末,可能含有Na2SO4,CaCO3,KCl,BaCl2,CuSO4中的一种或几种,按以下步骤进行实验:
1.将固体粉末溶于水得到无色溶液和白色沉淀;
2.加以足量的稀盐酸,沉淀部分溶解且有气泡产生。
根据以上实验产生的现象,判断这混合物里,一定含有 物质。一定没有
物质,可能含有的物质 。
写出1的反应方程式
写出2的反应方程式
A~G各物质间的关系如图,其中B、D为气态单质。
请回答下列问题:
(1)物质C、E分别为、。(填名称)
(2)反应①可选用不同的A进行,若反应在常温下进行,其化学方程式为。
(3)反应②的离子方程式为。
(4)新配制的F溶液应加入________以防止其转化为G。请设计实验检验F、G的混合溶液中F的金属阳离子。(写出试剂、操作、现象、结论)。
已知X,Y,Z,W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物(10e或18e)在常温下均为气态,在元素周期表中Z与W相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。
(1)Z离子的结构示意图是。
(2)X、Y、W可组成一种化合物,原子个数比为4:1:1,该化合物的化学式是,其中含有的化学键有 。
(3)X与Y所形成的分子的电子式为,它比同主族其他元素的氢化物沸点高的原因是。
(4)请设计一个简单的实验,说明Z、W两种元素非金属性的强弱,写出实验方法和现象:。
(8分)某无色透明溶液里加入紫色石蕊试液,溶液变红色,经分析该溶液中只可能存在下列离子:H+、Ba2+、Na+、Cu2+、OH-、SO42- ,
(1)请确定这些离子在该溶液中的存在情况:
一定存在的离子是;可能存在的离子是 ;
一定不存在的离子是;
(2)用离子方程式表示其中一种离子不能存在的原因 。
(10分)(1)在KCl和CaCl2的混合物中,K+和Ca2+的物质的量之比为2:1,则KCl和CaCl2的物质的量之比为,若要取出含1mol Cl-的该混合物,应称取该混合物的质量为g。
(2)同温、同压下某瓶充满O2时重106克,充满CO2时重112克,充满某气体时重98克。则某气体的相对分子质量为。
(3)铜和浓硫酸发生反应的化学方程式为:Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
在该反应中,若消耗了32 g Cu,则转移了_ __mol 电子 ,生成 _ _L SO2(标准状况)气体。
向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V(横坐标)的变化,沉淀总物质的量n的变化如图所示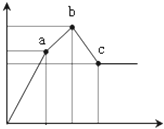
已知铝盐中滴加过量氨水能产生Al(OH)3沉淀,该沉淀遇强碱如NaOH溶液又可溶解。请回答下列问题:
(1)写出b﹣c发生反应的离子方程式:;
(2)下列说法正确的是
| A.a点的溶质为(NH4)2SO4 |
| B.b点溶液中一定存在:c(NH4+)+c(H+)=c(OH﹣) |
| C.b点沉淀为Al(OH)3和BaSO4 |
| D.C点溶液中一定存在:c(AlO2﹣)>c(Ba2+)>c(NH4+) |
(3)写出a﹣b发生反应的离子方程式:;
(4)滴加到c点共加入Ba(OH)2溶液的体积为mL,b、a两点沉淀的质量差为g(精确到0.001).