铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,请图甲中的横线上完成标注。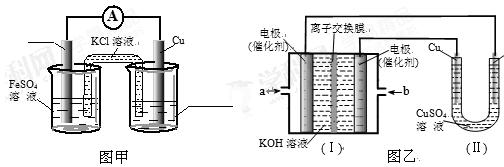
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ==4OH-;
若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后, 直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
某反应体系中反应物与生成物有:K2SO4、CaSO4、MnSO4、CaC2O4、KMnO4、H2SO4、H2O和一种未知气体X。
(1)已知CaC2O4在反应中失去电子,则该反应的氧化剂是。
(2)在标准状况下生成11.2LX时,有0.5mol 电子转移,共消耗0.25mol CaC2O4,X的化学式为。
(3)将氧 化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
(4)反应中CaC2O4表现性,发生反应,生成产物(选填“氧化”或“还 原”),氧化还原反应的本质是。
原”),氧化还原反应的本质是。
五种短周期元素的性质或原子结构信息如下表:
| 元素 |
元素性质或原子结构信息 |
| Q |
原子核外有6种不同运动状态的电子 |
| R |
最外层电子数是次外层电子数的3倍 |
| X |
气态氢化物的水溶液 呈弱碱性 呈弱碱性 |
| Y |
第三周期元素的简单离子中离子半径最小 |
| Z |
单质为银白色固体,在空气中燃烧发出黄色火焰 |
请根据表中信息回答下列问题:
(1)Q原子的电子排布式为___________________________,其同位素有。
(2)R与Z组成的化合物的化学式是。
(3)X气态氢化物分子的空间构型为。X的最高价氧化物对应的水化物其浓溶液与同类物质相比在化学性质上表现的特殊性有。
(4)Y单质与V2O5反应的化学方程式为。
(5)在1.01×105Pa、298K时,1.4gQR气体在1.6gR2气体中完全燃烧,生成QR2气体时放出14.15kJ热量,表示QR燃烧的热化学方程式为。
化合物ICl电子式,其中I的化合价为,你判断I化合价依据是,预测ICl与H2O反应的化学方程式为。你预测反应正确与否的实验依据是
(提示:AgI为黄色沉淀)(是/否)氧化还原反应。次碘酸的电子式。
(2)写出3种由多个原子组成的含有与 电子数相同的微粒的化学式、
电子数相同的微粒的化学式、
、。
1 mol单质A与足量盐酸反应,生成22.4L气体(标准状况下),并且元素A转化成与氖的电子层结构相同的离子,据以上事实,回答问题。
(1)元素A的原子结构示意图。
(2)元素A的最高价氧化物的水化物与盐酸反应的离子方程式。
(3)举出二个实验事实比较Na与元素A的金属性强弱、
。
已知X、Y、Z、W是短周期内的四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子就是一个质子,Y、Z在元素周期表中处于相邻位置,它们的单质在常温下均为无色气体,W元素的最高正价与最低负价的代数和为4。
(1)请写出元素符号W;
(2)W单质与Z单质的反应产物在一定条件下与Z单质反应,该反应的化学方程式:。
(3)这四种元素组成原子个数比为:8:2:4:1的化合物,该化合物的化学式为。
(4)Y元素的最高价氧化物对应的水化物与Y元素的氢化物可以反应,写出该反应的的化学方程式。