反应H2(g) + I2(g)  2HI(g)的平衡常数K1 ,反应 HI(g)
2HI(g)的平衡常数K1 ,反应 HI(g) 
 H2(g)+
H2(g)+ I2(g)的平衡常数K2 ,则K1、K2的关系为(平衡常数为同温度下的测定值)
I2(g)的平衡常数K2 ,则K1、K2的关系为(平衡常数为同温度下的测定值)
| A.K1=2K2 | B.K1=K22 | C.K1= |
D.K1= K2 K2 |
下列各组离子在溶液中能大量共存的是
| A.Ca2+ HCO3—、Cl—、K+ | B. Al3+、AlO2—、HCO3—、Na+ |
| C.Fe2+、NH4+、SO42—、S2— | D. Fe3+、SCN—、Na+、CO32— |
已知反应:①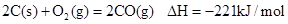 ②稀溶液中,
②稀溶液中,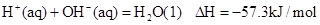 ,下列结论正确的是:
,下列结论正确的是:
| A.碳的燃烧热大于110.5kJ/mol |
| B.①的反应热为221kJ/mol |
| C.稀硫酸与稀NaOH溶液反应的中和热为△H=57.3kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量 |
分别放置在图4—10所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是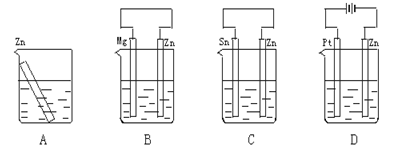
要除去MgCl2酸性溶液中少量的FeCl3,不宜选用的试剂是
| A.MgO | B.MgCO3 | C.NaOH | D.Mg(OH)2 |
一定温度下,可逆反应A2(g)+3B2(g) 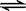 2AB3(g)达到平衡的标志是
2AB3(g)达到平衡的标志是
| A.容器内每减少1mol A2,同时生成2mol AB3 |
| B.容器内每减少1mol A2,同时生成3mol B2 |
| C.容器内A2、B2、AB3的物质的量之比为1:3:2 |
| D.容器内A2、B2、AB3的物质的量浓度之比为1:1:1 |