将1molSO2和1molO2通入一容积不变的密闭容器中,在一定温度和催化剂作用下发生反应 SO2(g)+  O2(g)
O2(g)  SO3(g)。达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为
SO3(g)。达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为
| A.等于0.3mol | B.等于0.15mol |
| C.小于0.15mol | D.大于0.15mol,小于0.3mol |
能源分类相关图如右图所示,下列四组选项中,全部符合图中阴影部分的能源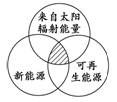
| A.煤炭、石油、沼气 |
| B.水能、生物能、天然气 |
| C.太阳能、风能、潮汐能 |
| D.地热能、海洋能、核能 |
已知H2SO4(aq)与Ba(OH)2(aq)反应的ΔH=-1584.2 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则生成BaSO4(s)的反应热等于
| A.-1528.6 kJ·mol-1 | B.+1528.6 kJ·mol-1 |
| C.+1473 kJ·mol-1 | D.-1473 kJ·mol-1 |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的反应热ΔH=2×(-57.3) kJ/mol |
| B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1 mol甲烷燃烧生成水和二氧化碳所放出的热量就是甲烷的燃烧热 |
C(s)+ O2(g)==="CO(g)" ΔH=―126.4 kJ/mol,这个热化学方程式表示
O2(g)==="CO(g)" ΔH=―126.4 kJ/mol,这个热化学方程式表示
| A.1 g碳燃烧生成一氧化碳时放出126.4 kJ的热量 |
| B.12 g碳燃烧生成一氧化碳时吸收126.4 kJ的热量 |
| C.1 mol固体碳在氧气中燃烧生成一氧化碳气体时放出126.4 kJ的热量 |
| D.碳的燃烧热为126.4 kJ/mol |
反应 A+B→C(ΔH<0)分两步进行:①A+B→X (ΔH >0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是