在298K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol/L NaOH溶液中充分反应,
测得反应放出x kJ的热量.已知在该条件下,1 mol CO2通入1 L 2 mol/L NaOH溶液中
充分反应放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是
| A.CO2 (g)+NaOH(aq)="==" NaHCO3 (aq)ΔH=-(2y-x) kJ/mol |
| B.CO2 (g)+NaOH(aq)="==" NaHCO3 (aq) ΔH=-(2x-y) kJ/mol |
| C.CO2 (g)+NaOH(aq)="==" NaHCO3 (aq)ΔH=-(4x-y) kJ/mol |
| D.CO2(g)+2NaOH(l)="==2" NaHCO3 (l)ΔH=-(8x-2y) kJ/mol |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.16g CH3OH中含有2nA个共价键 |
| B.1 mol•L-1CuCl2溶液含有2nA个Cl- |
| C.1 mol Fe与足量的C12反应,转移3nA个电子 |
| D.常温常压下,22.4L CH4中含有nA个CH4分子 |
能在水溶液中大量共存的一组离子是
| A.Na+、Mg2+、I-、ClO- | B.Al3+、NH4+、SO42-、Cl- |
| C.K+、Ag+、NO3-、Cl- | D.NH4+、Na+、OH-、SiO32- |
下列说法正确的是
| A.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| B.氨基酸、淀粉均属于高分子化合物 |
| C.植物油的主要成分是高级脂肪酸 |
D.1mol 最多能与5mo1 NaOH的水溶液完全反应 最多能与5mo1 NaOH的水溶液完全反应 |
常温下,将 pH和体积都相同的盐酸和醋酸溶液分别加蒸馏水稀释,pH随溶液体积变化如下图,下列有关叙述正确的是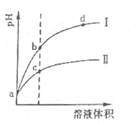
| A.曲线I为醋酸稀释时pH值变化曲线 |
| B.a点时,若都加入相同大小的锌粒,此时与盐酸反应的速率大 |
| C.a点时,若都加入足量的锌粒,最终与醋酸反应产生的氢气多 |
| D.b点溶液中水的电离程度比c点溶液中水的电离程度大 |
用下列装置进行相应实验,能达到目的的是
| A.用图1装置除去C12中少量的HCl |
| B.用图2装置蒸干NH4Cl饱和溶液制取NH4Cl晶体 |
| C.用图3装置制取纯净的CO2气体 |
| D.用图4装置分离CCl4萃取碘水后的有机层和水层 |